
| A. | 炼铁过程中的铁元素 | B. | 炼铁过程中的氧元素 | ||
| C. | 炼铁过程中的碳元素 | D. | 炼钢过程中的铁元素 |
分析 炼钢过程中反应原理:Fe+O2$\frac{\underline{\;高温\;}}{\;}$FeO、FeO+C$\frac{\underline{\;高温\;}}{\;}$Fe+CO 2FeO+Si$\frac{\underline{\;高温\;}}{\;}$2Fe+SiO2.结合元素的化合价变化解答.
解答 解:炼钢过程中反应原理:Fe+O2$\frac{\underline{\;高温\;}}{\;}$FeO、FeO+C$\frac{\underline{\;高温\;}}{\;}$Fe+CO 2FeO+Si$\frac{\underline{\;高温\;}}{\;}$2Fe+SiO2.
反应中C元素化合价升高,Fe元素发生Fe-FeO-Fe的一系列反应中,则Fe元素既失去电子也得到电子,所以既被氧化又被还原,
故选D.
点评 本题考查了氧化还原反应,把握化工生产中高炉炼铁所涉及的化学反应是解题的关键,题目难度不大,侧重于基础知识的考查.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑥ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
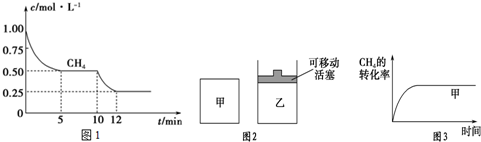
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子离核越近,能量越高 | |
| B. | 原子核外电子的运动没有规律 | |
| C. | 在多电子原子中,核外电子分层排布 | |
| D. | 电子一般尽可能排布在能量高的电子层中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期放置的苯酚晶体变红 | B. | 硝酸银晶体光照后变黑 | ||
| C. | 氢氧化亚铁变灰绿再变红褐 | D. | 二氧化碳气体冷却后变淡 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题


| A. | 反应①、③的原子利用率均为100% | |
| B. | 两种流程最终分离HCOOH都用洗涤液分液法 | |
| C. | 从原料充分利用角度看,流程二比流程一更优 | |
| D. | 两种流程总反应均为CO+H2O→HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中共价键越强,熔点越高 | |
| B. | 分子晶体中分子间作用力越大,分子越稳定 | |
| C. | 冰熔化时水分子中共价键发生断裂 | |
| D. | CaCl2晶体中含有两种化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
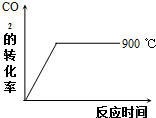 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:| 温度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com