
分析 原子序数依次增大的短周期元素a、b、c、d、e中,a原子的L层上s能级电子数等于p能极电子数,则a为C元素;
b和d的A2B型氢化物均为V形分子,则b是O、d是S元素,c的+1价离子比e的-1价离子少8个电子,则c是Na、e是Cl元素;
(1)b是O元素,b元素基态原子核外未成对电子为2p电子,有2个;
元素b、c、d分别是O、Na、S元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,同一主族元素第一电离能随着原子序数增大而减小;
(2)由这些元素形成的三原子分子中,分子的空间结构属于直线形,说明中心原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论确定中心原子杂化方式;
(3)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于离子晶体的是NaCl,
晶胞体积=$\frac{m}{ρ}$.
解答 解:原子序数依次增大的短周期元素a、b、c、d、e中,a原子的L层上s能级电子数等于p能极电子数,则a为C元素;
b和d的A2B型氢化物均为V形分子,则b是O、d是S元素,c的+1价离子比e的-1价离子少8个电子,则c是Na、e是Cl元素;
(1)b是O元素,b元素基态原子核外未成对电子为2p电子,有2个;
元素b、c、d分别是O、Na、S元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,同一主族元素第一电离能随着原子序数增大而减小,所以第一电离能大小顺序是O>S>Na,
故答案为:2;O>S>Na;
(2)由上述元素组成的三原子分子中,分子的空间结构属于直线形的是CO2、CS2,中心原子采用sp杂化,故答案为:CO2、CS2;sp;
(3)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于离子晶体的是NaCl,
该晶胞中Na、Cl原子都是4,晶胞体积=$\frac{m}{ρ}$=$\frac{\frac{58.5}{{N}_{A}}×4}{ρ}$cm3=$\frac{234}{ρ{N}_{A}}$cm3=$\frac{234}{a{N}_{A}}$cm3,
故答案为:NaCl;$\frac{234}{a{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、分子空间构型判断、电离能等知识点,侧重考查学生判断及计算能力、空间想象能力,难点是晶胞计算,熟练掌握氯化钠、氯化铯晶胞结构特点及其配位数.


科目:高中化学 来源: 题型:解答题
 +CO2(g)?
+CO2(g)?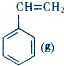 +CO(g)+H2O(g)△H
+CO(g)+H2O(g)△H ?
? +H2(g)△H1=+117.6kJ/mol
+H2(g)△H1=+117.6kJ/mol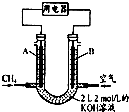
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
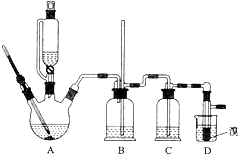
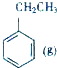
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力 | B. | 共价键 | C. | 氢键 | D. | 离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| u | 420 | 3100 | 4400 | 5900 |
| A. | T的氯化物最可能的化学式为TCl3 | |
| B. | 氦元素最有可能与Q元素位于同一族 | |
| C. | 在同周期表中,最可能处于同一族的是R和U | |
| D. | U元素最有可能为K,R元素最有可能为Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y的单质均具有较高的熔沸点 | |
| B. | 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X | |
| C. | 原子半径由大到小的顺序:X、Y、Z | |
| D. | Z、W形成的化合物中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢是宇宙物质中含量最多的元素 | |
| B. | 氢是名副其实的碱金属元素 | |
| C. | 氢气是无污染的新型能源 | |
| D. | 固态“金属氢”汽化的过程属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com