
【题目】用C、Mg和Al组成的混合物进行如下图所示实验。填写下列空白。
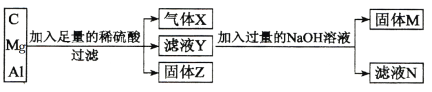
(1)气体X为 _________,固体Z为_____________。
(2)滤液Y中除H+外,还含有的阳离子为_________与__________;其中镁和稀硫酸反应的化学方程式为_________________________________________。
(3)滤液N中除Na2SO4和NaOH外,还含有的溶质为____________(填化学式);生成该物质的离子方程式为:________________________________。
(4)生成固体M的离子方程式为:________________________________。
【答案】H2 C Al 3+ Mg 2+ Mg + H2SO4== MgSO4 + H2↑ Na[Al(OH) 4] Al 3+ + 4OH—== [Al(OH) 4] — Mg 2++ 2OH—== Mg(OH) 2↓
【解析】
本题主要考查镁、铝相关知识。C与稀硫酸不发生反应,故固体Z为C,Mg、Al为活泼金属,能与非氧化性酸反应置换出H2,并生成相应的盐,故气体X为H2,滤液Y中溶质为H2SO4、MgSO4、Al2(SO4)3;加入过量的NaOH溶液后,生成可溶性的Na[Al(OH) 4]和Na2SO4以及难溶物Mg(OH)2,由此分析作答。
(1)由上述分析可知,气体X为H2;固体Z为C;
(2)由上述分析可知,滤液Y中还含有的阳离子为Mg2+、Al3+;其中镁和稀硫酸的反应的方程式为:Mg + H2SO4== MgSO4 + H2↑;
(3)由上述分析可知,滤液N中还含有的溶质为Na[Al(OH) 4];生成Na[Al(OH) 4]的离子方程式为:Al 3+ + 4OH-== [Al(OH) 4] -;
(4)固体M为Mg(OH)2,生成Mg(OH)2的离子方程式为:Mg 2++ 2OH-== Mg(OH) 2↓


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】图为一种特殊的热激活电池示意图,当无水LiCl-KCl混合物受热熔融后即可工作。 该电池总反应为: PbSO4(s)+2LiCl+Ca(s) = CaCl2(s)+Li2SO4+Pb(s)。下列说法不正确的是
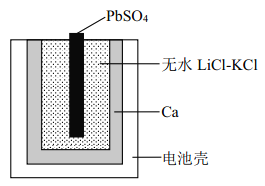
A. PbSO4 电极发生还原反应
B. 负极的电极反应:Ca + 2Cl--2e-=CaCl2
C. 放电时 Li+、 K+向正极移动
D. 用 LiCl 和 KCl 水溶液代替无水 LiCl-KCl,可将该电池改为常温使用的电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2=P4O10已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (4c+12b-6a-5d) kJ·mol-1 B. (6a+5d-4c-12b) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1 D. (4c+5d-4a-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】球形纳米银粉是一种重要的无机功能材料,被广泛应用于装饰材料、电接触材料、感光材料、催化剂、医药和抗菌材料等众多领域。从含Ag+的废定影液中回收并制备球形纳米银粉工艺流程图如下:

请回答下列问题:
(1)硝酸中所含元素的原子半径由小到大的顺序:____________;Na在周期表中的位置: _____________;N2H4的电子式:______________。
(2)为使Na2S溶液中![]() 的值减小,可加入的物质是__________。
的值减小,可加入的物质是__________。
A.盐酸 B.适量KOH C.适量NaOH D.适量CH3COONa
(3)写出置换过程的离子反应方程式 _____________________________________。
(4)若氧化精制过程产生等体积的NO2和NO混合气体,写出HNO3与Ag反应的化学反应方程式_____________。
(5)下图分别是HNO3浓度、浸取时间对银回收的影响,则最佳的浓度和时间分别是_____%;___min。


(6)加入N2H4·H2O还原前要将AgNO3溶液的pH调节至5~6,得到Ag的产率最高,pH>6时,银的产率降低的原因为__________________________。
(7)常温下,取上述AgNO3溶液滴加到物质的量浓度均为0.2mol/L NaNO2和CaCl2的混合溶液中(忽略溶液体积变化),当AgNO2开始沉淀时,溶液中c(Cl-)=__________mol/L[已知:常温下,Ksp(AgNO2)=2×10-8 ,Ksp(AgCl)=1.8×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究和验证氯气的性质,某研究性学习小组以MnO2和浓盐酸为主要原料,设计了如图所示装置(其中a是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行了研究。

(资料:氯气与铁反应制取氯化铁要在无水条件下进行)
试回答下列问题:
(l)装置A中发生反应的化学方程式为_____________________
(2)装置B中的试剂为_________,装置D里的药品是________
(3)装置C中发生反应的离子方程式为_____________________________
(4)反应开始后,装置E中玻璃管内的现象为_______________________________;可以检验生成物中有Fe3+的试剂是__________.
(5)装置F中发生反应的化学方程式为________________________
(6)利用氯气可以制得漂白粉,漂白粉的有效成份是_______________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,含Pm2.5的雾霾主要成分有CO2、SO2、NOx、CxHy及可吸入颗粒等。为减少雾霾要进行脱硝、脱硫、脱碳,请回答下列问题:
(1)脱硝。为消除NOx对环境的污染,利用NH3在一定条件下与NO反应生成无污染气体。
已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905kJ/mol
4NO(g)+6H2O(g) △H=-905kJ/mol
N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
①NH3(g)与NO(g)在一定条件下反应的热化学方程式为:______________________。
②下图是①中反应过程中NH3的体积分数随X变化的示意图,X代表的物理量可能是___________,原因是___________。

(2)脱硫。下图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4。

①装置中发生反应的化学方程式为___________。
②阴极的电极反应式是___________。
③某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为___________;常温下,在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)___________c(NO3-)(填写“>”“=”或“<”)。

(3)脱碳。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H 取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数
CH3OH(g)+H2O(g) △H 取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数![]() (CH3OH)与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H=___________0(填“>”“<”或“=”)。请解释b比a纵坐标大的原因___________。
(CH3OH)与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H=___________0(填“>”“<”或“=”)。请解释b比a纵坐标大的原因___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,该反应的化学方程式为__________,若将钠块放到石棉网上加热会生成______色固体,该反应的化学方程式为_______,该固体遇水会有无色无味的气体生成,该反应的化学方程式为___________,将氯气通入反应后的溶液中,发生反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料制得纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。
回答下列问题:
某探究活动小组欲在实验室中模拟制取纯碱,设计了Ⅰ、Ⅱ两种方案,并选择其一进行实验。
方案Ⅰ:(1)将足量CO2通入饱和NaCl溶液中;(2)再在所得溶液中通入足量NH3;(3)过滤;……。
方案Ⅱ:(1)将足量NH3通入饱和NaCl溶液中;(2)再在所得溶液中通入足量CO2;(3)过滤;……。
(1)部分实验装置如图所示。制取氨气的装置应选用________(选填编号)。

(2)写出实验中获得碳酸氢钠的离子方程式____________________________________________
(3)灼烧碳酸氢钠需要_________(选填编号)。
a.蒸发皿 b.坩埚 c.烧杯 d.烧瓶 e.酒精灯
(4)选择的实验方案是________(选填“Ⅰ”或“Ⅱ”),说明选择的理由____________________
(5)甲同学取少量产品完全溶于水,滴加稀硝酸2-3滴,再滴加硝酸银溶液,观察到有白色沉淀生成,得出纯碱含杂质Cl-的结论。乙同学认为甲的结论不一定正确,你认为乙同学的理由是_________________。
(6)按下列流程处理母液(提取完碳酸氢钠后的滤液)可得到NH4Cl。

通入NH3的作用是_______(选填编号)。操作a是_________________,操作b是___。
a.增大NH4+浓度,使NaHCO3更多地析出
b.增大NH4+浓度,使NH4Cl更多地析出
c.使NaHCO3转化为溶解度更大的Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中,正确的是( )
A. 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B. 0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后:c(![]() )>c(Cl-)>c(Na+)>c(OH-)>c(H+)
)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. 同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c(![]() )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com