
| A. | 加入相同物质的量浓度的盐酸 | B. | 加入相同物质的量浓度的硝酸 | ||
| C. | 加入相同物质的量浓度的硫酸 | D. | 加入少量的氯化钠溶液 |
分析 增大反应速率的方法有:增大反应物浓度、升高温度、增大压强(仅对有气体参加的反应)、加入催化剂、增大反应物的接触面积等,据此分析解答.
解答 解:A.加入相同物质的量浓度的盐酸,盐酸的总物质的量增大,但物质的量浓度不变,所以反应速率不变,故A错误;
B.稀释和锌反应生成氮氧化物而不是氢气,故B错误;
C.加入相同物质的量浓度的硫酸,溶液中氢离子浓度增大,反应速率加快,故C正确;
D.加入少量氯化钠溶液,溶液体积增大,氢离子物质的量不变,则氢离子浓度减小,反应速率减慢,故D错误;
故选C.
点评 本题考查影响化学反应速率的因素,侧重考查知识运用能力,明确影响反应速率因素及其影响原理是解本题关键,注意各个条件的适用范围,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度恒定不变 | B. | 混合气体的颜色不再改变 | ||
| C. | H2、I2、HI的浓度相等 | D. | 气体总物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
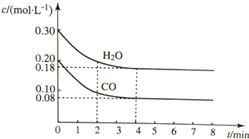 在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.
在容积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g)+H2O?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图所示.| t/min | c(CO)/(mol•L-1) | c(H2O)/(mol•L-1) | c(CO2)/(mol•L-1) | c(H2)/(mol•L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 1 | 0.138 | 0.238 | 0.062 | 0.062 |
| 2 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.084 |
| 6 | 0.096 | 0.266 | 0.104 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组的同学欲测定该补血剂中铁元素的含量.实验步骤如图:
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组的同学欲测定该补血剂中铁元素的含量.实验步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
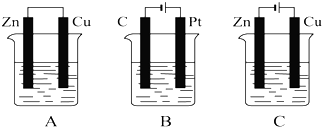
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
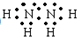 ,过氧化氢的结构式:
,过氧化氢的结构式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锡铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锌铁制品则相反 | |
| C. | 将纯水加热至较高温度,K变大、pH变小、呈酸性 | |
| D. | 给0.1mol•L-1CH3COOH溶液中加热,则c(H+)与c(CH3COOH)的比值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaCl配成一定物质的量浓度溶液 | B. | HCl溶于水 | ||
| C. | 水变成水蒸气 | D. | (NH4)2CO3加强热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com