
| A����������O2��O3�����ͣ���O2��O3Ϊ���ȷ�Ӧ |
| B����Ӧ�ٿ�ȷ������ȼ������708.7KJ |
| C��O3��O2�ȶ�����O2��O3Ϊ���ȷ�Ӧ |
| D����Ӧ�ڿ�ȷ������ȼ������779.78 kJ?mol��1 |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
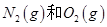 ��Ӧ����
��Ӧ���� �����е������仯������˵����ȷ����
�����е������仯������˵����ȷ����
A��ͨ������£�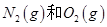 �����ֱ������NO �����ֱ������NO |
B��1mol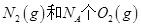 ��Ӧ�ų�������Ϊ180kJ ��Ӧ�ų�������Ϊ180kJ |
| C��NO��һ���������������NaOH��Һ��Ӧ�����κ�ˮ |
D��1mol �����������2mol �����������2mol  ��������� ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
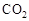 ����ȡ�״����䷴ӦΪ��CO2+3H2
����ȡ�״����䷴ӦΪ��CO2+3H2 CH3OH+H2O ���³�ѹ����֪���з�Ӧ�������仯��ͼʾ��
CH3OH+H2O ���³�ѹ����֪���з�Ӧ�������仯��ͼʾ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����������������������ֱ���ȫȼ�գ����߷ų��������� |
B����C��ʯī�� C�����ʯ�� ��H="+1.9" KJ/mol��֪�����ʯ��ʯī�ȶ� C�����ʯ�� ��H="+1.9" KJ/mol��֪�����ʯ��ʯī�ȶ� |
| C��1mol H2������Cl2��ȼ�շ���183KJ����H2��ȼ����Ϊ183KJ�� |
| D����ϡ��Һ�У�H+(aq)+OH-(aq)==H2O(l)��H="-57.3" kJ/mol,������0.5 mol H2SO4��Ũ�����뺬1 mol NaOH����Һ��ϣ��������̷ų�����������57.3 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����֪2H2��g����O2��g��= 2H2O��g������H=��483��6 kJ/mol����������ȼ����Ϊ241��8 kJ/mol |
| B����֪C��ʯī��s��= C�����ʯ��s������H��0������ʯ��ʯī�ȶ� |
| C����20��0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28��7 kJ����������÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽΪ��NaOH��aq����HCl��aq��=NaCl��aq����H2O��aq������H=��57.4 kJ/mol |
| D����֪2C��s����2O2��g��=2CO2��g������H1��2C��s����O2��g��=2CO��g�� ����H2�����H1<��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����H3����0��33 kJ��mol��1 |
| B����б��ת��Ϊ������ķ�Ӧ�����ȷ�Ӧ |
| C��S(��б��s)=S(������s) ��H3<0��������ȵ�б���ȶ� |
| D��S(��б��s)=S(������s) ��H3>0����б����������ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������ȵ�б���ȶ� |
| B��S(s����б)=S(s������)��H3����0��33 kJ/mol |
| C����ͬ���ʵ�����������ȵ�б�������е������� |
| D����ʽ��ʾ����1 mol O2�еĹ��ۼ������յ��������γ�1 mol SO2�еĹ��ۼ����ų���������297��16 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ۢ� | B���ڢܢ� | C���ڢۢ� | D���٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��KOH | B��CaCl | C��H O O | D��NaCl |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com