
下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.加入催化剂有利于氨的合成
D.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH |
| 阴离子 | Cl- CO |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是
___________________________________________________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈_______________________________________________性,原因是_________________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________________________________________________________。
充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
| 物质 | 甲 | 乙 | CO | H2 |
| 燃烧热/(kJ·mol-1) | 1 366 | 5 518 | 283 | 286 |
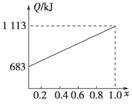
取甲、乙按不同比例混合的燃油23 g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如右图所示。试求:
(1)乙的相对分子质量Mr(乙)=________。
(2)160 g由甲、乙以等物质的量混合而成的燃油在347.2 L O2中恰好完全燃烧,得492.8 L气体,冷却到室温时,还剩余224 L(气体体积均在标准状况下测定)。由此可求得混合物中,C、H、O的原子个数比为________。甲、乙的分子式为:甲________;乙________。
(3)1 mol由甲、乙以等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2 876 kJ,则反应中生成CO________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)金属性最强的是 _,化学性质最不活泼的是__________。
(2)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是_____________。(填化学式)
(3)⑧的原子结构示意图为_________________,硒(Se)是人体必需的微量元素,与⑧同一主族且比⑧原子多一个电子层,则Se的原子序数为___________。
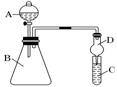 (4)若要证明非金属性:⑨>碘, 可向A中加浓盐酸,B中加KMnO4,(常温下KMnO4与浓盐酸反应),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为___________,即可证明。
(4)若要证明非金属性:⑨>碘, 可向A中加浓盐酸,B中加KMnO4,(常温下KMnO4与浓盐酸反应),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为___________,即可证明。
查看答案和解析>>
科目:高中化学 来源: 题型:
将20mL 0.5mol·L-1盐酸与一块状大理石反应,下列的措施不能提高化学反应速率的是( )
A.加入10mL 3mol·L-1盐酸
B.给反应混合物加热
C.将所用的大理石研磨成粉末
D.加入10mL蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g) CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥
C.②③⑤ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(g)+B(g) 2C(g)
2C(g)
若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·(L·s)-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在5L的密闭容器中进行下述反应
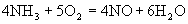
30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
A.V(O2 )=0.01mol·L-1·s-1 B. V(NO )=0.08mol·L-1·s-1
C. V(H2O)=0.01mol·L-1·s-1 D. V(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com