
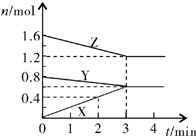
 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:分析 (1)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(2)根据v=$\frac{△c}{△t}$计算;
(3)从曲线的变化特点分析.
解答 解:(1)由图象可以看出,反应中Z、Y的物质的量减少,应为反应物,X的物质的量增多,应为生成物,
当反应进行到3min时,△n(Y)=0.2mol,△n(Z)=0.4mol,△n(X)=0.6mol,
则△n(Y):△n(Z):△n(X)=1:2:3,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为:Y+2Z?3X,
故答案为:Y+2Z?3X;
(2)反应开始至2min末,X的反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{0.4mol}{2L}}{2min}$=0.1mol/(L•min),故答案为:0.1;
(3)3min后,各物质的物质的量不再发生变化,说明反应达到反应限度,故答案为:在此条件下该反应已达到反应限度(或化学平衡).
点评 本题考查化学平衡图象问题,主要是图象数据分析、反应速率计算,题目难度不大,注意化学方程式的确定以及化学平衡状态的特征.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
| pH | 9 | 10 | 11 |
| c(Mg2+)/mol•L-1 | 10-1 | 10-3 | 10-5 |
| c(AlO2-)/mol•L-1 | 10-2 | 10-1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素等高分子化合物均属于纯净物 | |
| B. | 金属氧化物都是碱性氧化物 | |
| C. | 食醋、纯碱、食盐分别属于酸、碱、盐 | |
| D. | 丁达尔效应可用于区别溶液与胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于电负性很大的元素 | B. | 属于第n周期元素 | ||
| C. | 属于第ⅢA(主族)元素 | D. | 属于p区元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸加入蔗糖固体中 | B. | SO2使品红溶液褪色 | ||
| C. | 四氯化碳萃取碘水中的碘 | D. | 氨气溶于水,水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g CH4中含有的原子总数为5NA | |
| B. | 78g苯含有碳碳双键的数目为3NA | |
| C. | 1mol/L NaCl溶液中含有的氯离子数目为NA | |
| D. | 标准状态下,11.2L CH3COOH中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 水分子间存在π键 | B. | 水分子间存在氢键 | ||
| C. | 水分子是V形结构 | D. | 水分子是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期主族元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com