
【题目】I.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y原子的最外层电子数是电子层数的2倍,Z是地壳中含量最高的非金属元素,Q元素形成的单质是重要的半导体材料,R元素原子核外的M电子层电子数比L层少2个。请回答下列问题:
(1)画出Z的原子结构示意图__________,其氢化物的电子式__________。
(2)![]() 、Z、Q三种元素的原子半径由大到小的顺序__________
、Z、Q三种元素的原子半径由大到小的顺序__________![]() 用元素符号表示
用元素符号表示![]() 。
。
(3)![]() 元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________
元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________![]() 填字母序号
填字母序号![]() 。
。
![]() 过渡元素区域
过渡元素区域
![]() 金属和非金属元素的分界线附近
金属和非金属元素的分界线附近
![]() 含有氟、氯、硫、磷等元素的区域
含有氟、氯、硫、磷等元素的区域
![]() 下列能说明Y与R元素非金属性相对强弱的是__________。
下列能说明Y与R元素非金属性相对强弱的是__________。
![]() 单质与氢气化合的难易程度
单质与氢气化合的难易程度
![]() 含氧酸的酸性:
含氧酸的酸性:![]()
![]() 与R相互形成的化合物中元素的化合价
与R相互形成的化合物中元素的化合价
Ⅱ![]() 已知:
已知:

合成氨的热化学方程式是___________________________________。
Ⅲ![]() 有人设想以
有人设想以![]() 和
和![]() 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。

【答案】
![]()
![]() 第三周期第ⅣA族 32 b ac
第三周期第ⅣA族 32 b ac ![]()
![]()
![]()
【解析】
I.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X是原子半径最小的元素,是H,Y原子的最外层电子数是电子层数的2倍,是C,Z是地壳中含量最高的非金属元素是O,Q元素形成的单质是重要的半导体材料是Si,R元素原子核外的M电子层电子数比L层少2个是S元素。
Ⅱ.焓变等于生成物键能之和减去生成物键能之和;
Ⅲ.原电池中正极得电子发生还原反应。
(1)O原子结构示意图为 ,其氢化物为
,其氢化物为![]() ,其电子式为
,其电子式为![]() ,故答案为:
,故答案为: ;
;![]() ;
;
(2)![]() 、Z、Q分别是C、O、Si,原子半径大小顺序为
、Z、Q分别是C、O、Si,原子半径大小顺序为![]() ,故答案为:
,故答案为:![]() ;
;
(3)Q为Si元素,在第三周期第ⅣA族,与Si同主族第四周期的原子序数为14+18=32,半导体材料在金属与非金属分界线附近,故答案为:第三周期第ⅣA族;32;b;
(4)根据非金属性强弱判断依据可知ac正确,故答案为:ac;
Ⅱ![]() 首先写出反应的热化学方程式并标明状态:
首先写出反应的热化学方程式并标明状态:![]()
![]()
![]() ,再结合化学键与能量变化的关系可知
,再结合化学键与能量变化的关系可知![]() ,热化学方程式为
,热化学方程式为![]()
![]() ,故答案为:
,故答案为:![]()
![]() ;
;
Ⅲ![]() 首先写出反应的总反应方程式
首先写出反应的总反应方程式![]() ,在正极上得电子发生还原反应,应是
,在正极上得电子发生还原反应,应是![]() 得电子生成
得电子生成![]() ,再结合原子守恒和电荷守恒的知识可写出电极反应式为
,再结合原子守恒和电荷守恒的知识可写出电极反应式为![]() ,故答案为:
,故答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】![]() 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比![]() 高效,且腐蚀性小。请回答下列问题:
高效,且腐蚀性小。请回答下列问题:
(1)![]() 净水的原理是________________________________________。
净水的原理是________________________________________。![]() 溶液腐蚀钢铁设备,除
溶液腐蚀钢铁设备,除![]() 作用外,另一主要原因是(用离子方程式表示)__________________________________。
作用外,另一主要原因是(用离子方程式表示)__________________________________。
(2)![]() 在溶液中分三步水解:
在溶液中分三步水解:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
以上水解反应的平衡常数![]() 由大到小的顺序是___________________________________________________________。
由大到小的顺序是___________________________________________________________。
(3)通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为:![]()
![]()
![]()
欲使平衡正向移动可采用的方法是(填序号)________。
a.降温 b.加水稀释
c.加入![]() d.加入
d.加入![]()
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.0010 mol·L1酸性KMnO4溶液滴定未知浓度的无色NaHSO3溶液,反应的离子方程式为2![]() +5
+5![]() +H+=2Mn2++5
+H+=2Mn2++5![]() +3H2O。请完成下列问题:
+3H2O。请完成下列问题:
(1)该实验除了滴定管(50 mL)、铁架台、滴定管夹、烧杯 、白纸等仪器和用品外,还必须使用的仪器是____________。
(2)实验中用_____(填“酸”或“碱”)式滴定管盛装酸性KMnO4溶液,原因是_______。
(3)本实验_______(填“需要”或“不需要”)使用指示剂,滴定终点的现象是__________。
(4)①滴定前平视液面,刻度为a mL,滴定后俯视刻度为b mL,根据(ba) mL计算得到的待测液浓度比实际浓度_____(填“高”或“低”)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的待测液浓度值会____(填“偏小”“偏大”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
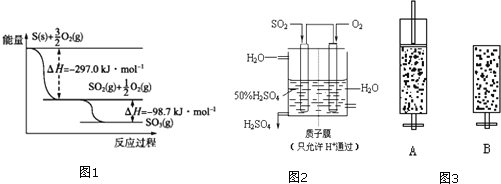
【题目】工业上利用硫黄生产硫酸的步骤及反应为:
①造气: ;
;
②催化氧化:![]() ;
;
③吸收:![]() 。
。
(1)根据图1写出![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式: ______ 。
的热化学方程式: ______ 。
(2)某温度下![]() ;
;![]() 。开始时在10L的密闭容器中加入
。开始时在10L的密闭容器中加入![]() 和
和![]() ,当反应达到平衡时共放出热量196kJ,求该温度下
,当反应达到平衡时共放出热量196kJ,求该温度下![]() 平衡常数K=______ 。
平衡常数K=______ 。
(3)某人设想以图2所示装置用电化学原理生产硫酸,写出通入![]() 的电极的电极反应式: ______ 。
的电极的电极反应式: ______ 。
(4)有两只密闭容器A和B,A容器有一移动的活塞能使容器内保持恒压,B容器能保持恒容,起始向这两只容器中分别充入等量的体积比为2:1的![]() 和
和![]() 的混合气体,并使A和B容积相等
的混合气体,并使A和B容积相等![]() 如图
如图![]() ,
,![]() 时发生如下反应:
时发生如下反应:![]() 填写下列空格:
填写下列空格:
①![]() 容器中
容器中![]() 的转化率比B容器 ______
的转化率比B容器 ______
②达到![]() 所述平衡后,若向两容器通入等量的原反应气体,达到平衡时A容器中
所述平衡后,若向两容器通入等量的原反应气体,达到平衡时A容器中![]() 的体积分数 ______
的体积分数 ______ ![]() 增大、减小、不变
增大、减小、不变![]() ,B容器中
,B容器中![]() 的体积分数 ______
的体积分数 ______ ![]() 增大、减小、不变
增大、减小、不变![]()
(5)对于反应![]() ,一定条件下达到平衡后,在保证O2浓度不变的情况下,增大容器的体积,试根据平衡常数,判断平衡 ______
,一定条件下达到平衡后,在保证O2浓度不变的情况下,增大容器的体积,试根据平衡常数,判断平衡 ______ ![]() 填“正向移动”、“逆向移动”或“不移动”
填“正向移动”、“逆向移动”或“不移动”![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )

A.粗盐水中含Ca2+、Mg2+、SO42-等离子,精制时除杂试剂BaCl2溶液应在Na2CO3溶液之前加入
B.标准状况下每生成22.4LCl2,便产生2 mol NaOH
C.从E口逸出的气体是Cl2
D.从B口加入含少量NaOH的水溶液以增强导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:

回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为______________________________、_______________________________________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是_______,滤渣是_______;过滤操作②的滤液是__________和___________,滤渣是______________。
(3)工艺过程中③和④的目的是____________________________________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是_____________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为__________________________;列式计算该成品的纯度________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,向体积均为20mL、浓度均为0.1000mol·L-1的三种酸HX、HY、HZ溶液中分别逐滴加入0.1000mol·L-1的NaOH溶液,所得溶液的pH与加入NaOH溶液的体积关系如图所示。下列说法正确的是( )

A.当V(NaOH溶液)=0mL时,三种溶液相比较c(X-)>c(Y-)>c(Z-)
B.当三种溶液pH均等于7时,反应消耗的n(HX)>n(HY)>n(HZ)
C.当V(NaOH溶液)=10mL时,反应后溶液中各离子浓度由大到小的顺序为c(X-)>c(Y-)>c(Z-)>c(Na+)
D.HY与HZ混合溶液中:c(H+)=c(Y-)+c(Z-)+![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com