
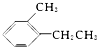
 ②
②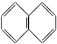 ③
③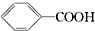 ④TNT
④TNT 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
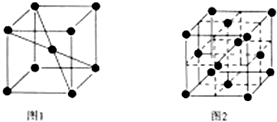
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
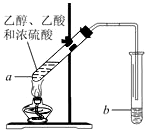 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热.
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
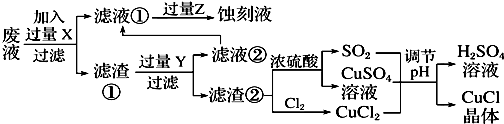
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Li<Na<K | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 稳定性:HCl>H2S>PH3 | D. | 还原性:F-<Cl-<Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体密度恒定不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | H2、I2、HI的浓度相等 | |
| D. | H2、I2、HI在混合气体中体积分数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molP4含有P-P键的个数为4NA | |
| B. | 1 mol Na2O2晶体中含有阴阳离子总数为4NA | |
| C. | 1mol金刚石中含有C-C键的个数为2NA | |
| D. | 1molSiO2中含Si-O键的个数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com