
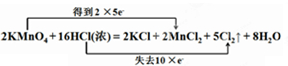
 ;
;分析 (1)依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;
(2)根据化合价的升降判断氧化剂、还原剂;利
(3)用电子的转移与气体的关系计算上生成的气体,先判断参加氧化还原反应的盐酸,再根据电子转移的量计算被氧化的盐酸.
解答 解:(1)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O,锰元素化合价从+7价降低到+2价;16HCl参与反应其中10HCl中氯元素化合价从-1价升高为0价;双线桥表示为: ,
,
故答案为: ;
;
(2)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,Mn元素由+7价降低到+2价,Cl元素的化合价由-1价升高到0,
高锰酸钾得电子是氧化剂,HCl失电子是还原剂,故答案为:KMnO4;HCl;
(2)设反应中有0.20mol 电子发生转移,生成氯气的体积为x,被氧化的HCl的物质的量是y;
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O 转移电子10e-,
所以电子与氯气的关系式为10e-~5Cl2
10mol 5×22.4L
0.20mol x
x=2.24L,
所以生成气体是2.24L;
每生成5mol氯气被氧化的HCl是10mol
2KMnO4+10HCl(浓)+6HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O 转移电子10e-,
所以被氧化的 HCl与转移电子之间的关系式为
10HCl~10e-
10 10
y 0.20mol
y=0.20mol,
所以被氧化的HCl为0.20mol,
故答案为:2.24L;0.20mol.
点评 本题考查学生氧化还原反应的有关知识以及相关计算问题,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大,注意灵活应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 第一电离能:Na<Mg<Al<Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题:
氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题: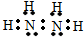 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
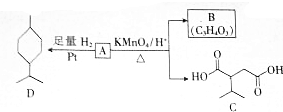
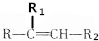 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$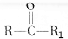 +R2COOH
+R2COOH .A与等物质的量的溴单质反应的产物有3种.
.A与等物质的量的溴单质反应的产物有3种. +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
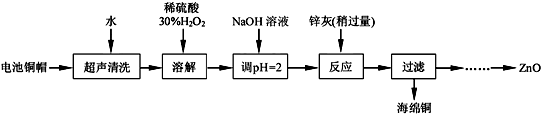
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中只含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com