
����Ŀ�������£���0.10 mol��L-1NaOH ��Һ�ֱ�ζ�20.00mL Ũ�Ⱦ�Ϊ0.10 mol��L-1CH3COOH��Һ��HCN��Һ���õζ���������ͼ������˵����ȷ����

A. ��ں͵����ʾ��Һ�ж��У�c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. ��ٺ͵����ʾ��Һ�У�c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. ��ۺ͵����ʾ��Һ�У�c(Na+)��c(OH-)��c(CH3COO-)��c(H+)
D. ��ٺ͵����ʾ��Һ�У�c(CH3COO-)��c(CN-)
���𰸡�B
��������A. ��ں͵����ʾ��Һ�е���غ���c(CH3COO-)+c(OH-)=c(Na+)+c(H+)�������ʾ��Һ�У�CH3COOH��1/2ת��ΪCH3COONa������pH<7������CH3COOH�ĵ���̶ȴ���CH3COONa��ˮ��̶���c(CH3COO-)>c(Na+)>c(CH3COOH)����ˣ�c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)�������ʾ��Һ����pH=7��c(OH-)=c(H+)������c(CH3COO-)=c(Na+)��c(Na+)>c(CH3COOH)����ˣ�c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)����A����B. ��ٺ͵����ʾ��Һ�У�c(CH3COO-)+c(CH3COOH)=c(CN-)+c(HCN)����c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)����B��ȷ��C. �����ʾ��Һ��c(OH-)=c(H+)�������ʾ��Һ��CH3COONaˮ��̶Ⱥ�С������ c(OH-)<c(CH3COO-)����C���� D. ��ٺ͵����ʾ��Һ�У�c(CH3COO-)+c(CH3COOH)=c(CN-)+c(HCN)������һ����ת��Ϊ�Σ������ʾ��ҺpH>7˵��CN-��ˮ��̶ȴ���HCN�ĵĵ���̶���c(HCN)>c(CN-)�������ʾ��ҺpH<7��˵��CH3COOH�ĵ���̶ȴ���CH3COONa��ˮ��̶ȣ�����c(CH3COO-)>c(CH3COOH)����ˣ�c(CH3COO-)>c(CN-)����D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ������ͭ���ڹ�ũҵ���������Ź㷺��Ӧ�á��ش���������:
��1��ͭԪ��λ��Ԫ�����ڱ��е�___�������̬ԭ�ӵļ۵����Ų�ͼΪ_________��
��2��������ͭ��Һ�м��������ˮ�����γ�[Cu(NH3)4]SO4��Һ������Һ�������ܽ���ά�ء�
��[Cu(NH3)4]SO4�������ӵ����幹����_______��
����[Cu(NH3)4]SO4�У������������еĻ�ѧ��Ϊ________���ṩ�µ��ӶԵijɼ�ԭ����_______��
�� ����Ԫ���⣬[Cu(NH3)4]SO4������Ԫ�صĵ縺����С�����˳��Ϊ_______��
��NF3��NH3�Ŀռ乹����ͬ������ԭ�ӵĹ���ӻ����;�Ϊ_____����NF3������Cu2+�γɻ�ѧ������ԭ����____________��
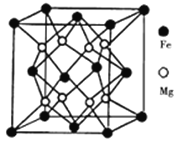
��3����þ�Ͻ���Ŀǰ�ѷ��ֵĴ����ܶ���ߵĴ������֮һ���侧���ṹ��ͼ��ʾ������þ�Ͻ�Ļ�ѧʽΪ________�����þ����IJ���Ϊdnm,��úϽ���ܶ�Ϊ____ g/cm3(���ػ�����NA��ʾ�����ӵ�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L1molL��1NaOH��Һ����0.6molCO2 �� ������Һ��Na2CO3��NaHCO3�����ʵ���֮��ԼΪ�� ��
A.2��3
B.1��2
C.2��1
D.3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��ͨ�����з�Ӧԭ���Ʊ�SO2����������̽������Ӧԭ��Ϊ��Na2SO3(��)+H2SO4(Ũ)�� Na2SO4 + SO2��+ H2O

��1����������ԭ���Ʊ����ռ�����SO2��ʵ��װ������˳��Ϊ________________��(���ͷ���)
��2��D��ʢװ���Լ�Ϊ_________________��
��3����ͬѧ��ע������ȡ������SO2�����װ��G����SO2������ʵ�飬��X��Na2S��Һ����Ŀ���Ǽ���SO2��_____________���ɹ۲쵽������_________ ��
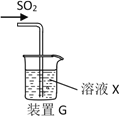
��4��ʵ��1����ͬѧ����ҺX��ΪŨ�Ⱦ�Ϊ0.1mol/L Fe(NO3)3��BaCl2�Ļ����Һ���Ѿ���ȥ�ܽ�������ͨ������SO2��۲쵽�ձ�������ɫ��������ͬѧ��Ϊ��ɫ����ΪBaSO4��Ϊ̽����ɫ�����ij�����������������ʵ����֤������֪��0.1mol/L Fe(NO3) 3��pH=2��
ʵ�� | ���� | ���� | ���ۺͽ��� |
2 | ��SO2ͨ��0.1mol/L ____��BaCl2���Һ | ������ɫ���� | Fe3+������H2SO3 |
3 | ��SO2ͨ��_______ �� BaCl2���Һ | ������ɫ���� | ��������NO3-�ܽ�H2SO3����ΪSO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ɫ��Ӧ��˵��������ǣ� ��
A.�۲�K2SO4����ɫӦ����ɫ���ܲ���
B.Na��NaCl������ʱ������ɫ��ͬ
C.��������ɫ��Ӧ������NaCl��KCl
D.��ɫ��Ӧһ��������ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ�õ��Ĵ�ʳ��ˮ�г���Ca2+��Mg2+��SO42��![]() ����Ҫ�����ᴿ�����к�����CaCl2��MgSO4�Ĵ�ʳ��ˮ���ڳ�ȥ���������ɳ֮��Ҫ��4���Լ��������ᡢ��Na2CO3����NaOH����BaCl2����ȥʳ��ˮ�е�Ca2+��Mg2+��SO42��
����Ҫ�����ᴿ�����к�����CaCl2��MgSO4�Ĵ�ʳ��ˮ���ڳ�ȥ���������ɳ֮��Ҫ��4���Լ��������ᡢ��Na2CO3����NaOH����BaCl2����ȥʳ��ˮ�е�Ca2+��Mg2+��SO42��![]() ���ᴿʱ�IJ�������ͼ����Լ��������ͼ��
���ᴿʱ�IJ�������ͼ����Լ��������ͼ��

ͼ��a��b��c��d�ֱ��ʾ����4���Լ��е�һ�֣���ش�
��1������A��������________��
��2���Լ�d��________���ж��Լ�d�Ѿ������ķ�����____________________��
��3������b��c����Һ�з����Ļ�ѧ��Ӧ�Ļ�ѧ����ʽ��__________________________(��д����)��
��4�������������������˳�����A��B��Cʱ�����õ�����____(�����)�������۵�������______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
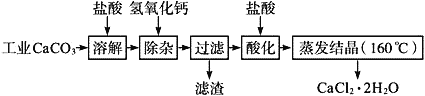
����Ŀ��ҽ���Ȼ��ƿ������������ơ������������ȣ��Թ�ҵ̼��ƣ�������Na+��Al3+��Fe3+������)����ҽҩ����ˮ���Ȼ���(CaCl2��2H2O����������Ϊ97.0%��103.0%)����Ҫ�������£�
��֪��
�������� | Fe��OH��3 | Al��OH��3 | Al��OH��3 | |
��ʼ����ʱ��pH | 2.3 | 4.0 | ��ʼ�ܽ�ʱ��pH | 7.8 |
��ȫ����ʱ��pH | 3.7 | 5.2 | ��ȫ�ܽ�ʱ��pH | 10.8 |
��1��CaCO3�����ᷴӦ�����ӷ���ʽ___________��
��2�������ӡ������Ǽ����������ƣ�������Һ��pH��ΧΪ________��Ŀ���dz�ȥ��Һ�е�����Al3+��Fe2+��
��3������ʱ���õıȲ�������__________��
��4�����ữ�������Ǽ������ᣬ������Һ��pHԼΪ4.0����Ŀ���У�����ֹ�����������տ����еĶ�����̼������ֹCa2+������ʱˮ�⣻��_______��
��5�������ᾧҪ������160����ԭ����__________��
��6���ⶨ��Ʒ��Cl-�����ķ����ǣ���ȡ0.750 0 gCaCl2��2H2O��Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ���ȡ25.00 mL������Һ����ƿ�У���0.050 00 mol/L AgNO3��Һ�ζ����յ㣨��K2Cr2O2��������AgNO3��Һ�����ƽ��ֵΪ20.39 mL��
�������ⶨ������������Һ��ϴ��������________��
������������Ʒ��CaCl2��2H2O����������Ϊ_______����������λ��Ч���֣�
���������������ⶨ����Ʒ��CaCl2��2H2O����������ƫ��(�ⶨ�����в��������ɺ���)�������ԭ����________��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(C8H8)���Ϊ�й���ľ��塣��˸�̼ԭ�ӶԳƵ�������������İ˸����ϡ��������˵���������
A. �������ڿ����п�ȼ��ȼ���к��̲���
B. ������һ������1�֡����ȴ�����3�֡����ȴ���Ҳ��3��
C. �������DZ�(C6H6)��ͬϵ�Ҳ�DZ���ϩ(C6H5-CH=CH2)��ͬ���칹��
D. ��������������ȫ�ֽ����ֻ����������̼�͵���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AԪ�ص������ӡ�BԪ�ص������Ӻ�CԪ�ص������Ӿ�����ͬ�ĵ��Ӳ�ṹ����֪A��ԭ����������B��ԭ����������A��B��C����Ԫ�ص����Ӱ뾶��С˳����(����)
A.A>B>CB.B>A>CC.C>A>BD.C>B>A
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com