
| △c |
| △t |
| △n |
| V?△t |
| 1.12L |
| 22.4L/mol |
| 0.05mol |
| 0.1L |
| 5.6g |
| 56g/mol |
| 0.1mol |
| 0.1L |
| △c(FeCl2) |
| △t |
| 0.5mol/L-0 |
| 2min |
| △c(FeCl2) |
| △t |
| 1.0mol/L-0.5mol/L |
| 4min |


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
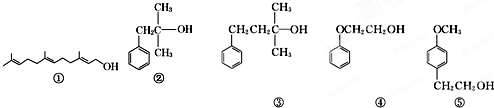
| A、可用酸性KMnO4溶液检验①中是否含有碳碳双键 |
| B、②和③互为同系物,均能催化氧化生成醛 |
| C、④和⑤互为同系物,可用核磁共振氢谱检验 |
| D、等物质的量的上述5种有机物与足量的金属钠反应,消耗钠的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该酒是在53℃条件下酿制的 |
| B、该酒的着火点为53℃ |
| C、100 mL该酒中含有53 mL酒精 |
| D、100g该酒中含有53g酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com