
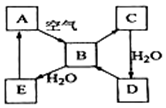
 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.分析 固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S,E为H2SO3,结合物质的性质以及题目要求可解答该题.
解答 解:(1)A为S,可与氢气反应生成硫化氢,反应的方程式为H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S,故答案为:H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S;
(2)H2SO3与H2S反应生成S,反应的方程式为H2SO3+2H2S═3S↓+3H2O,故答案为:H2SO3+2H2S═3S↓+3H2O;
(3)浓硫酸可与C、Cu等还原性物质在加热的条件下反应生成SO2,反应的方程式可为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等;
(4)将5mL 0.10mol•L-1的H2SO3溶液与10mL 0.10mol•L-1的NaOH溶液混合,二者恰好反应,反应的离子方程式为H2SO3+2OH-═SO32-+2H2O,
故答案为:H2SO3+2OH-═SO32-+2H2O.
点评 本题考查无机物的推断,为高考常见题型,答题时注意能与氧气反应生成气体的固体单质有C、S等元素,可以此作为该题的突破口进行推断,注意把握物质的化学性质,能熟练书写反应的化学方程式.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年河北省高一上第一次月考化学试卷(解析版) 题型:选择题
下列各物质或其主要成分的名称(或俗名)、化学式、类别一致的是 ( )
A.胆矾 CuSO4·5H2O 混合物 B.氖气 Ne 单质
C.烧碱 NaOH 氧化物 D.纯碱 NaOH 碱
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制硫酸亚铁溶液时,在配制的溶液中加入少许铁粉 | |
| B. | 发现酒精灯内酒精太少,熄火酒精灯,立即补加 | |
| C. | 用无水乙醇萃取溴水中的溴,然后通过蒸馏分离乙醇与溴 | |
| D. | 用溴的四氯化碳溶液除去甲烷中的乙烯杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在小苏打溶液中:NO3-、AlO2-、NH4+、K+ | |
| B. | 在空气中:H2S、CO2、SO2、CO | |
| C. | 在酸性高锰酸钾溶液中:C2H5OH、Na+、SO42-、CO32- | |
| D. | 在pH=8的溶液中:Na+、HCO3-、Br-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 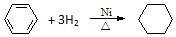 | |
| B. | CH2=CH2$\stackrel{催化剂}{→}$ 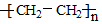 | |
| C. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属单质在反应中只作还原剂 | |
| B. | 非金属单质在反应中只作氧化剂 | |
| C. | 金属失电子越多,其还原性越强有力 | |
| D. | Cu2+比Fe2+氧化性强,Fe比Cu还原性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.
已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 失去电子的反应是还原反应 | B. | 发生氧化反应的是氧化剂 | ||
| C. | 作氧化剂的物质不能同时作还原剂 | D. | 失去电子的物质是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com