
| A、可用电解饱和的MgCl2溶液的方法获得金属镁 |
| B、电解熔融Al2O3方法冶炼金属铝时,用铁做阳极 |
| C、电解熔融Al2O3方法冶炼金属铝时,同时要加入冰晶石作熔剂 |
| D、工业上常采用活泼金属还原法冶炼金属银 |


科目:高中化学 来源: 题型:
| A、石油裂解可以得到氯乙烯 |
| B、石油的裂化是为了得到乙烯和丙烯 |
| C、煤的干馏的产物是焦炭、煤焦油、粗氨水和焦炉煤气 |
| D、煤中含有苯和甲苯,可以通过先干馏后分馏的方法得到苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2,3-二甲基-1-丁醇 |
| B、2,2-二甲基-1-丁醇 |
C、 |
| D、CH3-CH2-CH-CH2-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小 |
| B、用CO表示的平均反应速率为0.02mol?L-1?s-1 |
| C、当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变 |
| D、保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
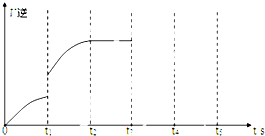 有可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2.
有可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在工业生产中,尽量使用纯液态有机物代替水作溶剂 |
| B、垃圾是放错地方的资源,应分类回收利用 |
| C、为了防止白色污染应提倡减少塑料袋的使用 |
| D、绿色化学的核心是利用化学原理消除污染的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁与盐酸反应放出氢气 |
| B、氢氧化钠与盐酸的反应 |
| C、硫在空气或氧气中燃烧 |
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol Na2O2含有的阴、阳离子总数是0.3 NA |
| B、1 mol?L-1的醋酸溶液中含醋酸分子数为NA |
| C、1.7 g 羟基(-OH)含有的电子数为0.9 NA |
| D、常温常压下,2.24 L乙烯含有的碳碳双键数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com