
【题目】磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O。
⑴CaSO4·2H2O脱水反应相关的热化学方程式为:
CaSO4·2H2O(s)=CaSO4·![]() H2O(s)+
H2O(s)+![]() H2O(g) ΔH1=83.2 kJ·mol-1
H2O(g) ΔH1=83.2 kJ·mol-1
CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=26 kJ·mol-1
H2O (g)=H2O(l) ΔH3=-44 kJ·mol-1
则反应CaSO4·![]() H2O(s)=CaSO4(s)+
H2O(s)=CaSO4(s)+ ![]() H2O(g)的ΔH4=_________kJ·mol-1。
H2O(g)的ΔH4=_________kJ·mol-1。
⑵用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸。
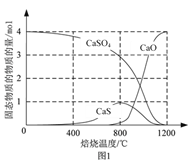
①以CO作还原剂,改变反应温度可得到不同的产物。不同温度下反应后所得固体成分的物质的量如图1所示。在低于800 ℃时主要还原产物为___________;高于800 ℃时主要发生的反应的化学方程式为___________。
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如下图2所示。CaCl2的作用是___________;当温度高于1200 ℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___________。

③以C作还原剂,向密闭容器中加入相同质量的几组不同C/S值(炭粉与CaSO4的物质的量之比)的混合物在1100 ℃加热,结果如上图3所示。当C/S值为0.5时,反应产物为CaO、SO2和CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是___________。
⑶利用反应CaSO4(s)+(NH4)2CO3(aq)![]() CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=___________。(已知Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-6)
CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=___________。(已知Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-6)
【答案】 30.8 CaS CaS+3CaSO4![]() 4CaO+4SO2↑ 作催化剂 两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动 高温下,过量的C与CO2反应生成CO,使气体总体积增大(或部分转化为其他含硫物质) 1.75×10-2 mol·L-1
4CaO+4SO2↑ 作催化剂 两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动 高温下,过量的C与CO2反应生成CO,使气体总体积增大(或部分转化为其他含硫物质) 1.75×10-2 mol·L-1
【解析】⑴已知:①CaSO4·2H2O(s)=CaSO4·![]() H2O(s)+
H2O(s)+![]() H2O(g) ΔH1=83.2 kJ·mol-1,②CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=26 kJ·mol-1,③H2O (g)=H2O(l) ΔH3=-44 kJ·mol-1,根据盖斯定律可知:②-①-③×2即得CaSO4·
H2O(g) ΔH1=83.2 kJ·mol-1,②CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=26 kJ·mol-1,③H2O (g)=H2O(l) ΔH3=-44 kJ·mol-1,根据盖斯定律可知:②-①-③×2即得CaSO4·![]() H2O(s)=CaSO4(s)+
H2O(s)=CaSO4(s)+ ![]() H2O(g),则ΔH4=(26 kJ·mol-1)-(83.2 kJ·mol-1)-(-44 kJ·mol-1)×2=30.8kJ·mol-1;
H2O(g),则ΔH4=(26 kJ·mol-1)-(83.2 kJ·mol-1)-(-44 kJ·mol-1)×2=30.8kJ·mol-1;
⑵①由图示可知在低于800 ℃时CaSO4主要还原产物为CaS;高于800 ℃时CaS和CaSO4反应生成CaO和SO2,根据电子守恒与原子守恒得此反应的化学方程式为CaS+3CaSO4![]() 4CaO+4SO2↑;
4CaO+4SO2↑;
②由图示可知CaCl2改变反应速率,但不改变最终CaSO4的转化率,说明CaCl2在转化过程中起催化剂作用;因催化剂CaCl2不改变平衡状态,当温度高于1200 ℃时,无论有无CaCl2,CaSO4的转化率趋于相同;
③因高温下过量的C与CO2反应生成CO,使气体总体积增大,导致混合气体中SO2的体积分数不升反降;
⑶反应的离子方程式为CaSO4(s)+CO32-(aq)![]() SO42-(aq)+CaCO3(s),则该反应的平衡常数K=
SO42-(aq)+CaCO3(s),则该反应的平衡常数K=![]() =
=![]() ,c(SO42-)=2.0 mol·L-1,故c(CO32-)=1.75×10-2 mol·L-1。
,c(SO42-)=2.0 mol·L-1,故c(CO32-)=1.75×10-2 mol·L-1。


科目:高中化学 来源: 题型:
【题目】在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应。
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
反应物 | 催化剂 | 温度 | |
① | 10mL10% H2O2溶液 | 无 | 25℃ |
② | 10mL20% H2O2溶液 | 无 | 25℃ |
③ | 10mL20% H2O2溶液 | 无 | 40℃ |
④ | 10mL20% H2O2溶液 | 1~2滴0.1mol/LFeCl3溶液 | 40℃ |
通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:

(1)代表实验①的图示是________________。
(2)对比实验③和④的目的是_____________。
(3)通过上面对比实验,所得的实验结论是_______。
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3 mol H2,一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),测得其中N2物质的量随时间变化如图所示。回答下列问题:
2NH3(g),测得其中N2物质的量随时间变化如图所示。回答下列问题:

(4)从开始反应到t2时刻,氨气的平均反应速率为_____________。
(5)在t3时刻,氢气的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 是短周期界元素中的四种非金属元素,它们的原子序数依次增大,
是短周期界元素中的四种非金属元素,它们的原子序数依次增大,![]() 元素的原子形成的离子就是一个质子,
元素的原子形成的离子就是一个质子,![]() 、
、![]() 在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,
在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,![]() 原子的最外层电子数是内层电子数的2倍。
原子的最外层电子数是内层电子数的2倍。
1.请写出![]() 在元素周期表中的位置为第________周期、第________族。
在元素周期表中的位置为第________周期、第________族。
2.气体分子![]() 的电子式为________________
的电子式为________________
3.由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素可组成酸式盐,该化合物的水溶液与足量
四种元素可组成酸式盐,该化合物的水溶液与足量![]() 溶液在加热条件下反应的离子方程式为_________________。
溶液在加热条件下反应的离子方程式为_________________。
4.在一定条件下,由![]() 单质与单质可化合生成
单质与单质可化合生成![]() ,工业上用
,工业上用![]() 检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质
检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质![]() 生成,写出化学方程式__________________________________。该反应中被氧化的
生成,写出化学方程式__________________________________。该反应中被氧化的![]() 与参与反应的
与参与反应的![]() 的质量之比____________。
的质量之比____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某一可逆反应来说,使用催化剂的作用是
A.催化剂在反应前后质量不变,故催化剂不参与化学反应
B.降低反应活化能,使反应速率加快
C.催化剂能够改变反应的反应热
D.催化剂只改变反应的正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳化硅的结构类似于金刚石的晶体,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中,它们的熔点从高到低的顺序是
A.①③② B.②③① C.③①② D.②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X(C4H6O5)广泛存在于许多水果内。该化合物具有如下性质:①1molX与足量金属钠反应产生1.5mol气体;②在有浓硫酸和加热条件下,X与醇或羧酸均反应生成有香味的产物;根据上述信息,对X的结构判断正确的是
A. 含有碳碳双键 B. 含有两个羧基和一个羟基
C. 含有一个羧基和两个羟基 D. 含有三个羟基和一个﹣COOR
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com