
| A. | 常温常压下,1mol甲基(14C1H3-)所含的中子数和电子数分别为8NA、10NA | |
| B. | 标准状况下,11.2L五氯化磷中含有P-Cl键的数目为2.5NA | |
| C. | 标准状况下,2.24L Cl2全部被NaOH溶液吸收,转移的电子数目为0.2NA | |
| D. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2molN2转移的电子数目为6NA |
分析 A、1个甲基(14C1H3-)中含有中子数为8、含有电子数为9,计算中子、电子的物质的量,再根据N=nNA计算;
B、标况下,五氯化磷为固体;
C、氯气与NaOH溶液的反应为歧化反应;
D、2NH3+NO+NO2═2N2+3H2O为归中反应,每生成2molN2转移6mol电子.
解答 解:A、1个甲基(14C1H3-)中含有中子数为8、含有电子数为9,中子物质的量为1mol×8=8mol、电子的物质的量为1mol×9=9mol,含有中子数为8mol×NAmol-1=8NA、电子数为9mol×NAmol-1=9NA,故A错误;
B、标况下,五氯化磷为固体,不能根据气体摩尔体积来计算,故B错误;
C、氯气与NaOH溶液的反应为歧化反应,1mol氯气转移1mol电子,故标况下2.24L氯气即0.1mol氯气转移0.1mol电子,即0.1NA个,故C错误;
D、2NH3+NO+NO2═2N2+3H2O为归中反应,每生成2molN2转移6mol电子,即6NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
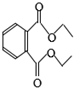
| A. | 该物质能使溴的四氯化碳溶液褪色 | |
| B. | 其分子式为C12H15O4 | |
| C. | 该物质完全水解能生成三种产物 | |
| D. | 1mol该物质与足量NaOH溶液反应能消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚氯乙烯均能使溴水褪色,发生加成反应 | |
| B. | 丁烷(C4H10)和二氯甲烷都存在同分异构体 | |
| C. | “地沟油”的主要成分是油脂,其成分与矿物油不同 | |
| D. | 淀粉,蛋白质,蔗糖都是能发生水解的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
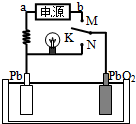 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )| A. | K与N相接时,能量由化学能转化为电能 | |
| B. | K与N相接时,H+向负极区迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑧ | B. | ⑤⑧ | C. | ②⑤⑥⑦ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和乙胺反应属于加成反应 | |
| B. | 室溫离子可以使熔盐燃料电池在常溫下工作 | |
| C. | CH3CH2NO3中,只有σ键没有π键 | |
| D. | 融化CH3CH2•NO3晶体需要破坏分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ca2+、HSO3-、Cl- (氨气) | B. | Ba2+、NO3-、Na+、Cl- (二氧化硫) | ||
| C. | Na+、K+、HCO3-、Cl- (二氧化碳) | D. | Al3+、SO42-、HCO3-、NO3- (氯化氢) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com