
|
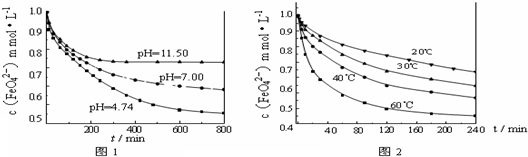
某学习小组拟利用如图装置制备氮化钙(化学式为Ca3N2,极易与水反应).下列说法正确的是
| |
| [ ] | |
A. |
打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好 |
B. |
U形管中盛放的干燥剂既可以是碱石灰,也可以是浓硫酸 |
C. |
将产物Ca3N2放入盐酸中,只能得到一种盐 |
D. |
反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省卫辉市高三3月考试化学试卷 题型:选择题
.某学习小组拟利用如图装置制备氮化钙(化学式为Ca3N2,极易与水反应)。下
列说法正确的是
A.打开活塞K通入N2,试管A内有气
泡产生,说明装置气密性良好
B.U形管中盛放的干燥剂既可以是碱石
灰,也可以是浓硫酸
C.将产物Ca3N2放入盐酸中,只能得到一种盐
D.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K
查看答案和解析>>
科目:高中化学 来源: 题型:
.某学习小组拟利用如图装置制备氮化钙(化学式为Ca3N2,极易与水反应)。下
列说法正确的是
A.打开活塞K通入N2,试管A内有气
泡产生,说明装置气密性良好
B.U形管中盛放的干燥剂既可以是碱石
灰,也可以是浓硫酸
C.将产物Ca3N2放入盐酸中,只能得到一种盐
D.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com