
| A. | ②⑤⑥ | B. | ②④ | C. | ④⑤ | D. | ①③⑥ |
分析 ①铁与氧气生成四氧化三铁,与氯气生成氯化铁,与硫单质氯化亚铁;
②质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
③苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢根离子;
④在由水电离出的c(OH-)=10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子;
⑤冰为分子晶体,既存在范德华力又存在氢键;
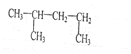
⑥ 的最长碳链含有5个C,主链为戊烷.
的最长碳链含有5个C,主链为戊烷.
解答 解:①1 mol铁在一定条件下分别与氧气、氯气、硫完全反应,与氧气生成四氧化三铁,转移了$\frac{8}{3}$mol电子,与氯气反应生成氯化铁,转移了3mol电子,与S反应生成FeS,转移了2mol电子,故①错误;
②质子数为92,中子数为142的铀(U)原子的质量数为234,该原子正确的表示方法为:92234U,故②错误;
③向苯酚钠溶液中通入少量的CO2,反应生成苯酚和碳酸氢根离子,正确的离子方程式为:CO2+H2O+C6H2O-=C6H5OH+HCO3-,故③错误;
④在由水电离出的c(OH-)=10-13mol•L-1的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,Na+、Ba2+、Cl-、I-之间不反应,都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故④正确;
⑤冰是分子晶体,所以冰中含有范德华力,且该物质中含有氢键,故⑤正确;
⑥ 为烷烃,最长碳链含有5个C,主链为戊烷,编号从左边开始,甲基在2号C,该有机物正确名称为:2-甲基戊烷,故⑥错误;
为烷烃,最长碳链含有5个C,主链为戊烷,编号从左边开始,甲基在2号C,该有机物正确名称为:2-甲基戊烷,故⑥错误;
故选C.
点评 本题考查较为综合,涉及离子共存、有机物命名、元素符号、物质的量的计算、离子方程式书写等知识,题目难度中等,试题知识点较多,充分考查学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应KClO3+6HCl═3C12↑+KCl+3H2O,每生成1.5molC12转移电子数为2.5NA | |
| B. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | 1L0.1mol/LNH4Cl溶液中NH4+的数目为0.1NA | |
| D. | 40gSiC中含有Si-C键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 甲烷(乙烯) | 溴水 | 洗气 |
| B | 氢氧化钠溶液(氢氧化钙溶液) | 二氧化碳 | 过滤 |
| C | 乙烯(SO2) | 酸性KMnO4 | 洗气 |
| D | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol•L-1亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5molCH5+中含有的电子数目为5NA | |
| D. | 常温下,1L0.5mol•L-1Ba(OH)2溶液中水电离的OH-个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
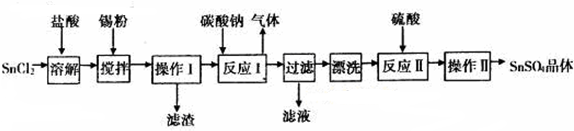
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO中少量O2:通过灼热的Cu网后收集气体 | |
| B. | 除去K2CO3中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去N2中少量NH3,可依次通过水、浓H2SO4洗后收集气体 | |
| D. | 可用铁粉除去FeCl3溶液中的少量的CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com