
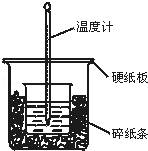
50mL 0.50mol•L﹣1盐酸与50mL 0.55mol•L﹣1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)烧杯间填满碎纸条的作用是 .
(2)大烧杯上如不盖硬纸板,求得的中和热的数值 (填“偏大”“偏小”“无影响”).
(3)从实验装置上看,图中尚缺少环形玻璃搅拌棒,如此求得的中和热的数值 (填“偏大”“偏小”“无影响”).
(4)实验中改用60mL 0.50mol•L﹣1盐酸跟50mL 0.55mol•L﹣1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热相等(填“相等”“不相等”),简述理由: .
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50mL 0.50mol•L﹣1NaOH溶液进行上述实验,测得的中和热的数值会 .(均填“偏大”“偏小”“无影响”)
考点: 中和热的测定.
专题: 化学反应中的能量变化.
分析: (1)中和热测定实验成败的关键是保温工作;
(2)不盖硬纸板,会有一部分热量散失;
(3)图中尚缺少环形玻璃搅拌棒,导致反应不充分,放出热量偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析;用50mL 0.50mol•L﹣1NaOH溶液进行上述实验,消耗的盐酸偏小,放出的热量偏少.
解答: 解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)图中尚缺少环形玻璃搅拌棒,导致反应不充分,放出热量偏小,中和热的数值偏小,故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL 0.50mol•L﹣1盐酸跟50mL 0.55mol•L﹣1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:不相等;相等;中和热是指酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱的用量无关;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,测得的中和热的数值会偏小;用50mL 0.50mol•L﹣1NaOH溶液进行上述实验,消耗的盐酸偏小,放出的热量偏少,中和热的数值会偏小,故答案为:偏小;偏小.
点评: 本题考查中和热的测定,题目难度中等,注意理解中和热的概念是解题的关键.


科目:高中化学 来源: 题型:
T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6mol A和3mol B,发生反应如下:3A(g)+bB(g)⇌3C(g)+2D(g)△H<0; 4min时甲容器内的反应恰好达到平衡,A的浓度为2.4mol/L,B的浓度为1.8mol/L; t min时乙容器内的反应达平衡,根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)= ,化学方程式中计量数b= .
(2)乙容器中反应达到平衡时所需时间t 4min(填“大于”、“小于”或“等于”).
(3)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是AC.
A.保持温度不变,增大甲容器的体积至2L
B.保持容器体积不变,使甲容器升高温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
(4)写出平衡常数表达式K= ,并计算在T℃时的化学平衡常数K .
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
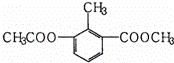
A. 一个分子中含有12个H原子
B. 能使酸性KMnO4溶液褪色
C. 苯环上的一氯代物有2种
D. 1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在100g碳不完全燃烧所得气体中,CO占1/3体积,CO2占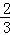 体积,且:
体积,且:
C(s)+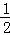 O2(g)═CO(g)△H=﹣110.35kJ;
O2(g)═CO(g)△H=﹣110.35kJ;
CO(g)+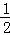 O2(g)═CO2(g)△H=﹣282.5kJ
O2(g)═CO2(g)△H=﹣282.5kJ
与这些碳完全燃烧相比,损失的热量是()
A. 392.92 kJ B. 2489.4 kJ C. 784.72 kJ D. 3274.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
CH3﹣CH3→CH2=CH2+H2,有关化学键的键能如下:
化学键 C﹣H C=C C﹣C H﹣H
键能(kJ/mol) 414.4 615.3 347.4 435.3
计算该反应的反应热. kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
若在铜片上镀银时,下列叙述正确的是()
①将铜片接在电源的正极上
②将银片接在电源的正极上
③在铜片上发生的反应是:Ag++e﹣→Ag
④在银片上发生的反应是:4OH﹣﹣4e﹣→O2↑+2H2O
⑤需用硫酸铜溶液为电镀液
⑥需用硝酸银溶液为电镀液.
A. ①③⑥ B. ②③⑥ C. ①④⑤ D. ②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在水中加入等物质的量的Ag+、Pb2+、Na+、SO42﹣、NO3﹣、Cl﹣,该溶液放在用惰性材料做电极的电解槽中,通电片刻后,则氧化产物与还原产物的质量之比为()
A. 35.5:108 B. 16:207 C. 8:1 D. 108:35.5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A. 等物质的量的NaX和弱酸HX混合后的溶液中c(HX)可能大于c(X-)
B. 在pH=4.5的NaHSO3溶液中,c(H2SO3)大于c(SO32-)
C. 向0.1 mol/L醋酸溶液中加水稀释的过程中c(OH-)不断增大
D. 向含有Na2SO4的BaSO4悬浊液中加水稀释,c(Ba2+)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com