
【题目】近年来由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g) = NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l) = H2O(g) △H = +88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式____________________________。
(2)已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:

下列说法正确的是______________________(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.4min内CO2的反应速率为0.003 mol/(L·min)
D.第8min时,若充入氦气,不会导致v正(CO) < v逆(H2O)
(3)850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,amol CO2和bmol H2。若达平衡时各组分体积分数都与(2)中平衡时相同,则a=____________mol,b=________mol。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:

①上述生产过程的能量转化方式是_________________。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑,则阴极的电极反应式为__________________________。
【答案】 2NH3(g)+ CO2(g)=CO(NH2)2(s)+H2O(l) △H = -130.98 kJ·mol-1 BD 3.0 3.0 太阳能和电能转化为化学能 3CO2 + 4e-= C + 2CO32-
【解析】(1)已知:①2NH3(g)+ CO2(g) = NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l) = H2O(g) △H = +88.0 kJ·mol-1
根据盖斯定律可知①+②-③即得到NH3和CO2合成尿素和液态水的热化学方程式为2NH3(g)+ CO2(g)=CO(NH2)2(s)+H2O(l) △H = -130.98 kJ·mol-1。
(2)A.由图可知,平衡时△c(CO)=0.2mol/L-0.08mol/L=0.12mol/L,浓度变化量之比等于化学计量数之比,故△c(H2)=△c(CO)=0.12mol/L,故n(H2)=0.12mol/L×10L=1.2mol,A错误;B.生成1.2mol氢气,放出的热量为41.2kJ×1.2mol/1mol=49.44kJ,B正确;C.4min内CO2的浓度变化量是0.12mol/L,所以反应速率为0.12mol/L÷4min=0.03 mol/(L·min),C错误;D.恒容密闭容器中,若充入氦气,体积不变,各物质的浓度不变,速率不变,D正确,答案选BD;(3)在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,amol CO2和bmol H2,若要与(2)中平衡是等效平衡,则全部转化为反应物,与(2)中起始的量等比例即可;设实际转化的CO2和 H2为xmol,所以转化为反应物时,c(CO)=(1+x)/2mol/L,c(H2O)=(3+x)/2mol/L,已知(2)中反应物的起始量为c(CO)=0.2mol/L,c(H2O)=0.3mol/L;则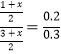 ,解得:x=3;所以初始时CO2和 H2的物质的量均为3mol,即a=b=3;(4)①根据装置图可判断上述生产过程的能量转化方式是太阳能和电能转化为化学能。②阴极发生得到电子的还原反应,反应中有碳生成,则阴极是CO2得到电子,电极反应式为3CO2 +4e-=C+2CO32-。
,解得:x=3;所以初始时CO2和 H2的物质的量均为3mol,即a=b=3;(4)①根据装置图可判断上述生产过程的能量转化方式是太阳能和电能转化为化学能。②阴极发生得到电子的还原反应,反应中有碳生成,则阴极是CO2得到电子,电极反应式为3CO2 +4e-=C+2CO32-。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。

下列分析不正确的是: ( )
A. 0~4分钟时,A的平均反应速率为0.02mol/(Lmin) B. 该反应的平衡常数表达式K=![]()
C. 由T1向T2变化时,V正> V逆 D. 此反应的正反应为吸热反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是( )
A. 元素周期表共有18个族
B. 主族元素全部都是金属元素
C. 元素周期表共有7个周期
D. 短周期是指第一、二周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
下列说法错误的是( )
A. 在实验室实施操作①需要的玻璃仪器是漏斗、烧杯、玻璃棒
B. Mg(OH)2―→MgCl2的离子方程式为:Mg(OH)2+2H+===Mg2++2H2O
C. 操作②是将MgCl2溶液蒸干后冷却结晶
D. 操作④阴极和阳极产物的质量比是24∶71
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为_________,C、N、O三种元素的第一电离能由大到小的顺序为_________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2, 1 mol CN中含有的π键的数目为_________。与CN互为等电子体的分子有_______ (写出一种即可)。
(3)在络离子[Cu(NH3)4] 2+中 NH3 的 VSEPR 模型为____________,其中N原子的杂化轨道类型为_________。
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______________________。
(5)晶体是由无数晶胞___________而成。铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为______,若该晶胞的晶胞参数为d nm,则该合金的密度为______g/cm3 (不必化简,用NA表示阿伏加德罗常数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 石油裂解是为了获得更多汽油,以满足迅速增长的汽车需要
B. 1mol冰醋酸和1mol乙醇反应生成的水分子数目为NA
C. 沸点:汽油<煤油<柴油<润滑油
D. 乙酸分子中不含醛基,所以不能与新制的Cu(OH)2悬浊液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用灼烧的方法鉴别羊毛线和棉线 B. 光导纤维的主要成分是二氧化硅
C. 铁红是Fe2O3可为红色涂料主要成份 D. 中和胃酸过多可用Na2CO3、Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁粉和氧化铜的混合物8.32g,进行如下实验:根据实验所得数据,有关说法正确的是

A. 无色气体的质量为0.2g
B. 原混合物中铁的质量为7.0g
C. 反应后的溶液中金属离子物质的量为0.1mol
D. 反应消耗的H2SO4物质的量为0.15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中铁元素的检验可经过以下四个步骤完成:将茶叶灼烧灰化→用浓硝酸溶解茶叶灰→过滤得到的滤液→检验滤液中的Fe3+.如图是可能用到的实验用品.

有关该实验的说法中正确的是( )
A. 第一步需选用仪器①、②和⑨,①的名称叫钳埚
B. 第二步用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C. 要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸
D. 第四步,若滤液中含有Fe3+,加入⑧中的溶液后滤液会显红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com