


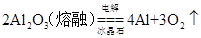 ②
②
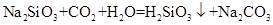
 4Al+3O2↑。
4Al+3O2↑。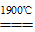 SiC+2CO↑。
SiC+2CO↑。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:单选题
| IA | IIA | IIIA | IVA |
| | | | Q |
| X | | Y | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
| A.非极性共价键 | B.极性共价键 | C.配位键 | D.离子键 E.氢键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y、Z、X、W的原子序数依次减小 |
| B.W与X可形成既含极性共价键又含非极性共价键的化合物 |
| C.由W、X、Y、Z四种元素组成的常见化合物一定显酸性 |
| D.X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5 、+3、 -3 | -2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.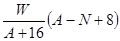 mol mol | B.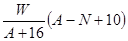 mol mol |
| C.(A-N+8)mol | D.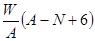 mol mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:CH4> SiH4 >HF | B.原子半径:Na>Mg>O |
| C.酸性:HClO4>H2SO4>H3PO4 | D.非金属性:F>Cl>Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com