
| A. | 氢氟酸 | B. | 浓盐酸 | C. | 溴水 | D. | 碘化银固体 |
分析 玻璃瓶的主要成分为二氧化硅,能够与二氧化硅反应的试剂不能变成在玻璃塞的试剂瓶中,除了氟化氢外,多数试剂可以不存在玻璃瓶中,据此进行判断.
解答 解:A.氢氟酸和二氧化硅反应生成四氟化硅,所以不能用玻璃瓶盛放氢氟酸,要用塑料瓶盛放,故A错误;
B.浓盐酸为酸性,不与二氧化硅反应,可以存在玻璃瓶中,故B正确;
C.溴水见光易分解,应储存在棕色试剂瓶中,故C错误;
D.碘化银固体见光易分解,应储存在棕色试剂瓶中,故D错误.
故选B.
点评 本题考查了化学试剂的保存方法判断,题目难度不大,注意掌握常见化学试剂的性质及保存方法,如见光分解的需要保存在棕色试剂瓶中,能够与二氧化硅反应不能使用玻璃塞的试剂瓶盛放等,总之试剂的存放遵循安全性、保纯性、方便性原则.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题

| A. | Te原子的相对原子质量是127.5 | |
| B. | Te元素可能会有多种同位素 | |
| C. | Te原子5p亚层有2对成对电子 | |
| D. | Te原子最外层有6个运动状态相同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 氧化铝常被用于制作作耐火材料 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | Na2O2具有强氧化性,不能用作呼吸面具中的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
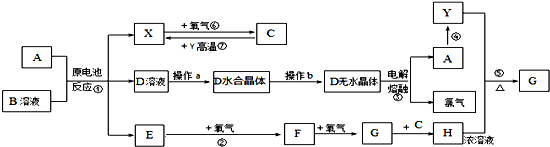
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | B. | 乙醇的分子式:C2H4O | ||
| C. | 四氯化碳的电子式: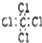 | D. | 异丁烷的结构简式:CH(CH3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
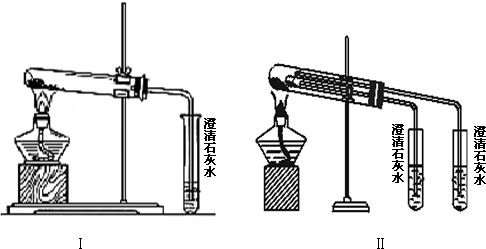
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
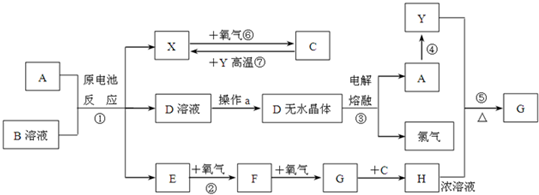
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
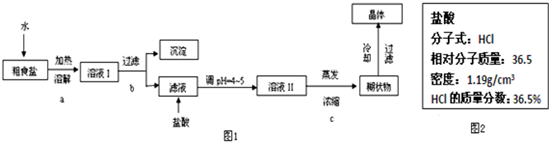
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com