
 ;
; ;Al3+<Na+<O2-;
;Al3+<Na+<O2-;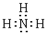 ,检验氨气的常用方法是:用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在,
,检验氨气的常用方法是:用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在,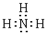 ;用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在;
;用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在;

 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
| A、电解前电解质溶液的浓度为0.2mol/L(假设溶液体积不变) |
B、 若用Al--H2O2电池(如图)为电解的电源,则理论上应消耗Al的质量为2.7g |
| C、若向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,得到标况下0.896LNO气体,所得溶液中加KSCN溶液,无血色出现,则溶液的混合物中含铁元素的质量为4.48g |
| D、阳极产生O2在标况下体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3的分解率为20% |
| B、10分钟内ν(SO2)=0.01mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、加压,容器内固体的质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
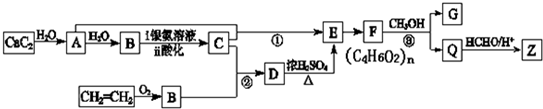
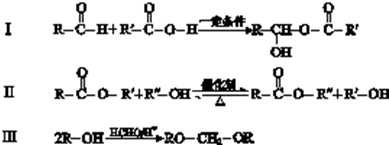
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

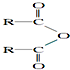
| H2O |
| LiAlH4 |
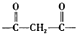 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
 (NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com