
分析 (1)三个热化学方程式依次编号为①、②、③,根据盖斯定律,(①×2+②×6+③)÷6得,C(s)+O2(g)═CO2(g)△H=$\frac{1}{6}$(2a+6b+c)kJ•mol-1,则C的燃烧热为$\frac{2a+6b+c}{6}$kJ•mol-1;
(2)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(3)以熔融的K2CO3与CO2为反应的环境,负极是失电子发生氧化反应的电极.
解答 解:已知:①Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=a kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=b kJ•mol-1
③4Fe(s)+3O2(g)═2Fe2O3(s)△H3=c kJ•mol-1
据盖斯定律,(①×2+②×6+③)÷6得:C(s)+O2(g)═CO2(g)△H=$\frac{1}{6}$(2a+6b+c)kJ•mol-1,则C的燃烧热为$\frac{2a+6b+c}{6}$kJ•mol-1,故答案为:$\frac{2a+6b+c}{6}$;
(2)能设计成原电池的反应是放热的氧化还原反应.
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2C0(g)+02 (g)═2C02 (g )反应放热,且为氧化还原反应,故可以设计成原电池,故C正确;
D.2H2(g)+O2(g)=2H2O(1)△H<0,该反应为氧化还原反应,且为放热反应,能设计为原电池,故D正确;
故答案为:CD;
(3)若为一氧化碳燃料电池,在熔融的K2CO3与CO2为反应的环境中,传到离子为碳酸根离子,负极是一氧化碳失电子生成二氧化碳,电极反应为:CO-2e-+CO32-=2CO2 ;若为氢氧燃料电池,则负极上放电的为氢气,电极反应为:H2-2e-=2H+,故答案为:CO-2e-+CO32-=2CO2或H2-2e-=2H+.
点评 本题考查原电池的设计和燃料电池的电极反应书写,题目难度中等,明确原电池与氧化还原反应的关系及负极发生氧化反应是解答本题的关键,试题培养了学生的灵活应用能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
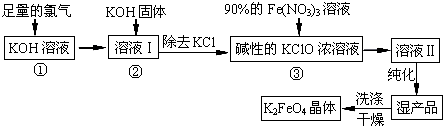
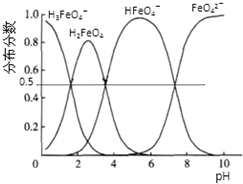
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的相对分子质量为34g | |
| B. | CH4的摩尔质量为16 g | |
| C. | 1 mol SO42--的质量为96g | |
| D. | 标准状况下1 mol H2O 的体积是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol | B. | 1.6mol | C. | 0.4mol | D. | 0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
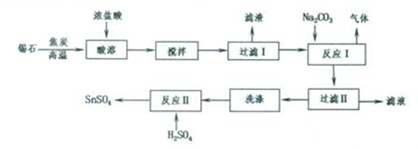
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 橙花醇的分子式为C15H24O | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 在一定条件下能发生取代、催化氧化、酯化、加聚反应 | |
| D. | 0.1mo1橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗0.3mo1Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com