
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 向硫酸钠溶液中加入氯化钡溶液 | 硫酸铜溶液中插入铁片 | 向FeSO4溶液中滴入NaOH溶液 | 加热盛有浓硫酸和木炭的试管 |
现象 | 产生白色沉淀 | 铁片上出现红色物质 | 产生白色沉淀,迅速变成灰绿色,最终变为红褐色 | 产生刺激性气味的气体 |
A. A B. B C. C D. D
【答案】A
【解析】
A向硫酸钠溶液中加入氯化钡溶液,发生反应:SO42-+ Ba2+= BaSO4![]() ,没有化合价发生变化,不属于氧化还原反应,故A选;
,没有化合价发生变化,不属于氧化还原反应,故A选;
B硫酸铜溶液中插入铁片发生反应:Fe+Cu2+= Fe2++ Cu,反应中有元素的化合价发生变化,属于氧化还原反应,故B不选;
C向FeSO4溶液中滴入NaOH溶液发生反应:Fe2++2OH-= Fe(OH)2![]() ,4Fe(OH)2+O2+2H2O= 4Fe(OH)3,有元素化合价发生变化,属于氧化还原反应,故C不选;
,4Fe(OH)2+O2+2H2O= 4Fe(OH)3,有元素化合价发生变化,属于氧化还原反应,故C不选;
D加热盛有浓硫酸和木炭的试管发生反应:2H2SO4+C=CO2![]() +2SO2
+2SO2![]() +2H2O, 有元素化合价发生变化,属于氧化还原反应,故D不选;答案:A。
+2H2O, 有元素化合价发生变化,属于氧化还原反应,故D不选;答案:A。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用二氧化锰与浓盐酸共热制取氯气。某化学兴趣小组为制取较为纯净、干燥的氯气设计了如下实验装置。

请按要求回答下列问题:
(1)仪器X的名称为_________________。
(2)已知装置B中选用的试剂为饱和食盐水,其作用为 __________________。
(3)将氯气通入C中的紫色石蕊试液,可以观察到的现象是________________________。
(4)装置E中装有NaOH溶液,该装置中反应的化学方程式 ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是

A.N4属于一种新型的化合物
B.N4分子中存在非极性键
C.N4分子中N—N键角为109°28′
D.1 mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:

①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
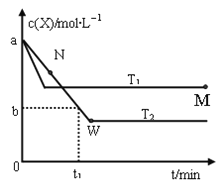
A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C. M点的正反应速率υ正大于N点的逆反应速率υ逆
D. M点时再加入一定量的X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)将 28.5 g 氯化镁溶于水配成的 500mL 溶液中 Cl-浓度是______________,写出氯化镁的电离方程式_________________________________________________________。
(2)质量都是 50 g 的 HCl、NH3、CO2、O2 四种气体,在相同温度和相同压强条件下,体积最大的是____________。
(3)配制 90 mL 0.1 mol/L CuSO4 溶液,需要 CuSO4·5H2O_______ g,下列操作会使所配溶液浓度偏高的是__________________________。
A.容量瓶洗涤干净后未干燥 B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C.定容时俯视刻度线 D.烧杯和玻璃棒未洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com