
| A. | Fe | B. | Ag | C. | Mg | D. | Na |
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题
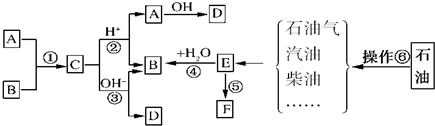
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 洗去沾在手上的敌敌畏用碱性肥皂较好 | |
| B. | 洗去沾在手上的敌敌畏用中性香皂较好 | |
| C. | 敌敌畏极易溶于水 | |
| D. | 敌敌畏可以发生加成反应,不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃中通入足量的CO2:SiO32-+2CO2+2H2O═H2SiO3 (胶体)+2CO32- | |
| B. | 氯化亚铁溶液中通入足量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | NaHCO3溶液中加入足量NaHSO4溶液:2H++CO32-═CO2↑+H2O | |
| D. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
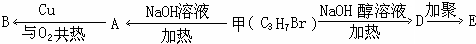
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热至较高温度,水的离子积变大,pH减小,呈酸性 | |
| B. | 碱性氢氧燃料电池工作时,OH-向正极迁移 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0 | |
| D. | 用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com