
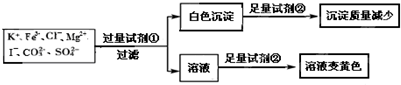
| A. | 该溶液中一定有I-、CO32-、SO42-、K+ | |
| B. | 试剂①为硝酸钡 | |
| C. | 通过黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl- | |
| D. | 试剂②一定为盐酸 |
分析 由实验可知,加试剂①为硝酸钡溶液,生成白色沉淀为碳酸钡和硫酸钡,则加试剂②为盐酸,沉淀减少,硫酸钡不溶于酸;加试剂①过滤后的滤液中,再加试剂②为盐酸,氢离子,硝酸根离子、I-发生氧化还原反应生成碘,溶液为黄色,以此来解答.
解答 解:由实验可知,加试剂①为硝酸钡溶液,生成白色沉淀为碳酸钡和硫酸钡,则加试剂②为盐酸,沉淀减少,硫酸钡不溶于酸,则原溶液中一定存在CO32-、SO42-,则不含Fe3+、Mg2+;加试剂①过滤后的滤液中,再加试剂②为盐酸,氢离子,硝酸根离子、I-发生氧化还原反应生成碘,溶液为黄色,溶液为电中性,则一定含阳离子为K+,
A.由上述分析可知,该溶液中一定有I-、CO32-、SO42-、K+,故A正确;
B.由上述分析可知,试剂①为硝酸钡,故B正确;
C.黄色溶液中加入硝酸银可生成AgI沉淀,试剂②加盐酸引入氯离子,不能检验原溶液中是否存在Cl-,故C错误;
D.由上述分析可知,试剂②一定为盐酸,因碳酸钡与硫酸反应生成硫酸钡使沉淀量增加,故D正确;
故选C.
点评 本题考查物质鉴别、检验的实验方案设计,为高频考点,把握白色沉淀的成分、黄色溶液中含碘为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:解答题
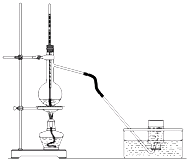 实验室制取乙烯的装置如图所示,请回答:
实验室制取乙烯的装置如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
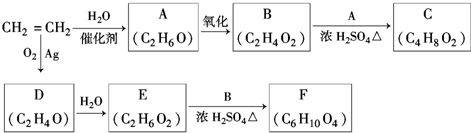
 ,该反应的类型为酯化反应;
,该反应的类型为酯化反应; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 0.1 | 0.5 | 1 | 10 | |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
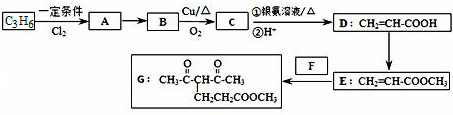
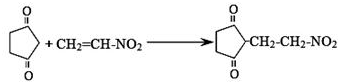
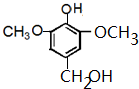 或
或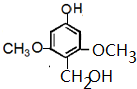
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
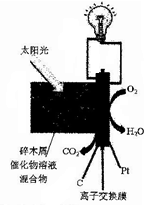 日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )
日前,美国科学家开发出一种直接以生物质为原料的低温燃料电池.将木屑(主要成分为纤维素)磨碎后与一种多金属氧酸盐催化物溶液相混合,置于阳光或热辐射下就会开始工作(如图所示).关于该电池说法错误的是( )| A. | 该电池为生物质能的利用提供了一个很好的途径 | |
| B. | 该离子交换膜为质子交换膜 | |
| C. | 电源负极周围溶液的pH值升高 | |
| D. | 碎木屑发生氧化反应:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(C032-) | |
| B. | 向0.1mol/L氯化铵溶液中滴加浓盐酸可能有c(NH4+)=c(H+) | |
| C. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7 | |
| D. | 将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:c(Na+)=c(A-)+c(Cl-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
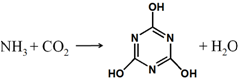 CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应.下列有关三聚氰酸的说法正确的是( )| A. | 分子式为C3H6N3O3 | B. | 分子中既含有σ键又含有π键 | ||
| C. | 分子中既含极性键,又含非极性键 | D. | 生成该物质的上述反应为中和反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com