
【题目】球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:

下列说法不正确的是
A. 固体2是氧化铁
B. X的化学式可以表示为Fe3C2
C. 溶液甲加热、蒸发、灼烧也可得到24.0g固体
D. X与足量的热浓硝酸反应有NO2和CO2生成
【答案】B
【解析】试题分析:铁碳化合物X,在足量的空气中煅烧得固体1为铁的氧化物,可以有+2价或+3价的铁,溶于盐酸所得溶液中可能亚铁离子或铁离子,再通入足量的氯气,溶液中都为+3价的铁,加热蒸发,铁离子水解,生成氢氧化铁,灼烧后氢氧化铁分解得到固体2为氧化铁,24克氧化铁中含有铁元素的质量为112×24/160=16.8克,利用元素守恒分析,可计算化合物X中铁元素的质量也为16.8克,进而求得X中碳元素的质量为18-16.8=1.2g,所以在X中铁、碳原子的物质的量之比为16.8/56:1.2/12=3:1,所以X得化学式为Fe3C,其余热的浓硝酸发生氧化还原反应,碳元素可被氧化成二氧化碳,硝酸中的氮可被还原为二氧化氮,根据上面的分析可知。A、固体2为氧化铁,正确,不选A;B、X为Fe3C,错误,选B;C、溶液甲中可能含有铁离子,正确,不选C;D、X与足量的热浓硝酸反应有二氧化氮和二氧化碳,正确,不选D。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的类别正确的是( )
A.盐:碳酸氢钠 氯化铵 纯碱
B.电解质:H2SO4 Ba(OH)2 CO2
C.氧化物:H2O CO HNO3
D.混合物:空气 玻璃 胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3 B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布式为1s22s22p2 D. Z元素具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是 I1=738 kJ/mol;I2=1 451 kJ/mol;I3=7 733 kJ/mol;I4=10 540 kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式______________________________。
(2)B基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为![]() 该同学所画的电子排布图违背了_____________________________________。
该同学所画的电子排布图违背了_____________________________________。
(4)G位于________族________区,价电子排布式为________。
(5)检验F元素的方法是________,请用原子结构的知识解释产生此现象的原因是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 淀粉水解后的溶液加入新制Cu(OH)2浊液,再加热 | 无砖红色沉淀 | 淀粉水解产物不含醛基 |
C | 用铂丝蘸取少量溶液进行焰色反应 | 火焰呈黄色 | 该溶液是钠盐溶液 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1 nol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法完全正确的是( )
A.放热反应均是自发反应
B.如果ΔH和ΔS 均为正值,当温度升高时,反应可能自发进行
C.ΔS为正值的反应均是自发反应
D.物质的量增加的反应,ΔS为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
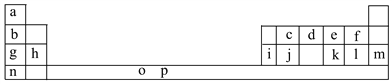
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___________________。
(2)d与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是__________________________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
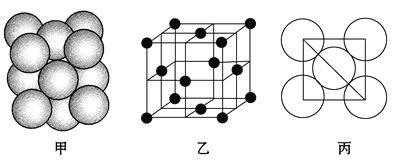
请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到目的是
A. 用焰色反应鉴別Na2CO3溶液和NaCl溶液
B. 用分液漏斗分离食醋中的乙酸与水
C. 用结晶的方法分离氯化钠和硝酸钾的混合物
D. 用NaOH溶液除去Cl2中混有的少量HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com