
【题目】T1 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 2.00 | 3.00 |
t1 | 0.80 | |
t2 | 1.80 |
A. 用H2表示反应在t1 min内的平均速率为v(H2)=0.60/t1mol·L-1·min-1
B. 保持其他条件不变,若起始时向容器中充入3.00 mol CO和2.00 mol H2O(g),达到平衡时,n(CO2)=1.20 mol
C. 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO转化率将增大
D. 温度升至T2 ℃,上述反应的平衡常数为0.70,则正反应的ΔH<0
【答案】C
【解析】
A.CO的物质的量的变化为(2.00-0.80)mol,反应在t1min内的平均速率为v(CO)=(2.00-0.80)mol ÷2L÷t1min =(0.60/t1)mol·L-1·min-1,根据反应速率之比等于化学计量数之比,t1min内H2的平均反应速率与CO的平均反应速率相同,故A正确;
B.根据t2>t1,对比表中数据可知t1 min时已经达到平衡状态,而反应物和生成物的化学计量数都为1,则其它条件不变,起始时向容器中充入的3.00 molCO和2.00 molH2O(g)与充入2.00molCO和3.00molH2O(g)达平衡时,反应的限度相同,故达到平衡时,n(CO2)=1.20 mol,故B正确;
C.增大反应物CO的浓度,平衡正向移动,CO转化率减小,水蒸气的转化率增大,故C错误;
D.T1℃时,该反应的平衡常数为K=(1.2/2)×(1.20/2)÷(0.80/2)×(1.80/2)=1,T2℃,上述反应的平衡常数为0.70,温度升高,平衡常数减小,平衡逆向移动,说明正反应为放热反应,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.短周期是指第1、2周期B.过渡元素全部是金属元素
C.元素周期表有8个副族D.IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
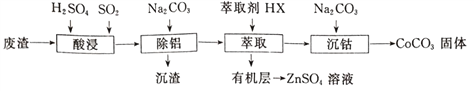
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、X、W、D、E为短周期元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物可使湿润的红色石蕊试纸变蓝, A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为______________________。W的原子结构示意图为________。
(2)A、X 两种元素能形成含18电子的分子,请写出该分子的电子式:_______________。
用电子式表示化合物D2W的形成过程______________________________________。
(3)下列事实能说明W元素的非金属性比S元素的非金属性强的是________ (填字母)。
a.W单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol W单质比1 mol S得电子多
c.W和S两元素的简单氢化物受热分解,前者的分解温度高
(4)实验室制备A和X形成的气态化合物的化学方程式为____________________________。
(5)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式_________________________________________________________________________。
(6)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱电解质的电离常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数3.67×105
HCN+ HCOO-的化学平衡常数3.67×105
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A的结构简式如图:
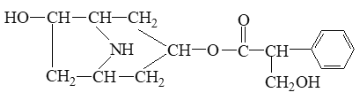
(1)A分子式是______________。
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香化合物。B和C的结构简式是B:______________,C:_____________。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是_________________。
(4)写出同时符合下列两项要求的E的所有同分异构体的结构简式_____。
①化合物是1,3,5—三取代苯
②苯环上的三个取代基分别为甲基.羟基和含有-COO-结构的基团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物W的分子式为C9H12 ,其含有苯环的结构有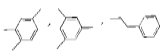 等,下列说法错误的是( )
等,下列说法错误的是( )
A. ![]() 与苯互为同系物
与苯互为同系物
B. 除了上述三种物质,W的含苯环的同分异构体还有5种
C. 有机物W的一种结构为![]() 该有机物不能与溴单质发生加成反应
该有机物不能与溴单质发生加成反应
D. 有机物W不管是否含有苯环,在一定条件下都能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内存在着酸碱平衡,如出现失衡将对人体健康产生极大危害。人体内生成的下列酸属于无机物的是
A. 乳酸(C3H6O3) B. 磷酸(H3PO4)
C. 丙酮酸(C3H4O3) D. 乙酰乙酸(C4H6O3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com