
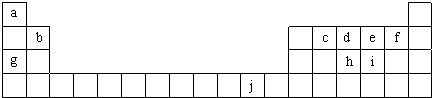
| 5-1×3 |
| 2 |


科目:高中化学 来源: 题型:
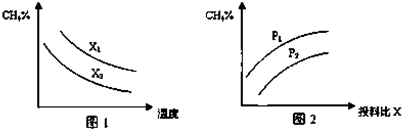
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量 浓度(mol/L) | NaOH物质的 量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
n- 3 |
n- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
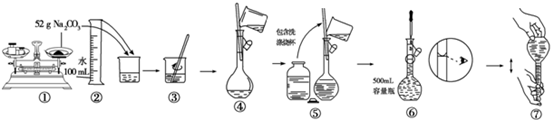
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com