
 常温下,用 0.1000molL -1NaOH溶液滴定 20.00mL0.1000molL -1CH 3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000molL -1NaOH溶液滴定 20.00mL0.1000molL -1CH 3COOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 滴定过程中可能出现:c (CH 3COO -)>c (Na +)>c (CH 3COOH)>c (H +)>c (OH -) | |
| B. | 点①所示溶液中酸的中和率大于50% | |
| C. | 点②是二者恰好中和点 | |
| D. | 点③所示溶液中:c (Na +)>c (OH -)>c (CH 3COO -)>c (H +) |
分析 由图可知,点①为CH3COONa与CH3COOH物质的量之比为1:1的混合物,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH);
点②的pH=7,即c(H+)=c(OH-),若恰好生成CH3COONa,水解显碱性,则此时醋酸剩余;
点③时体积相同,则恰好完全反应生成CH3COONa,CH3COO-水解呈碱性,则c(Na+)>c(CH3COO-),以此来解答.
解答 解:A.由点①为含等量的CH3COONa与CH3COOH的溶液,CH3COOH电离程度大于CH3COO-的水解程度,故c (CH 3COO -)>c(Na+)>c(CH3COOH),且电离显酸性,显性离子大于隐性离子,则滴定过程中可能出现:c (CH 3COO -)>c (Na +)>c (CH 3COOH)>c (H +)>c (OH -),故A正确;
B.由体积和浓度可知,点①为CH3COONa与CH3COOH物质的量之比为1:1的混合物,即醋酸反应了一半,溶液中酸的中和率为50%,故B错误;
C.点②pH=7,即c(H+)=c(OH-),若恰好生成CH3COONa,水解显碱性,则此时醋酸剩余,故C错误;
D.点③说明两溶液恰好完全反应生成CH3COONa,因CH3COO-水解显碱性,且程度较小,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
故选A.
点评 本题考查酸碱混合的定性判断,为高频考点,把握图中pH与溶液体积的关系、各点溶液中的溶质为解答该题的关键,侧重分析与应用能力的考查,注意电离与水解的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 气体A是SO2和CO2的混合气体 | |
| B. | 固体A一定含有SiO2,可能含有BaSO4 | |
| C. | 该固体混合物中Fe2O3和Fe至少有其中一种 | |
| D. | 该固体混合物一定含有Fe、Na2SO3、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | 与Al同周期,金属性最强 |
| Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
| Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
| W | 单质紫黑色,遇淀粉溶液显蓝色 |
 ;W在元素周期表中的位置是第五周期第ⅦA族;
;W在元素周期表中的位置是第五周期第ⅦA族;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g分子式为CnH2n的烃中含有的C-H键的数目一定为2NA | |
| B. | 1mol Fe与水蒸气反应生成的氢气为22.4L | |
| C. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| D. | 0.1mol H2S分子中含氢离子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)<v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率大于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2-m | B. | a+m+n | C. | 2n+3a-m | D. | 2+a+2n-m |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 +2H2O,其反应类型为酯化反应.
+2H2O,其反应类型为酯化反应. .
.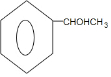 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. (填结构简式)
(填结构简式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com