

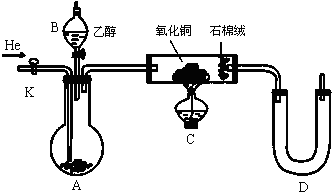
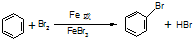 ,该反应为取代反应,所以苯分子中不存在碳碳单双键交替,所以凯库勒观点错误,生成的溴化氢极易溶于水,所以C中产生“喷泉”现象,
,该反应为取代反应,所以苯分子中不存在碳碳单双键交替,所以凯库勒观点错误,生成的溴化氢极易溶于水,所以C中产生“喷泉”现象,| x |
| 500 |
| y |
| 500 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
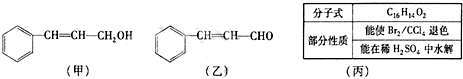
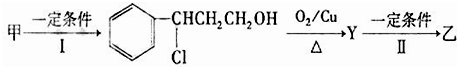
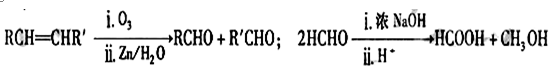
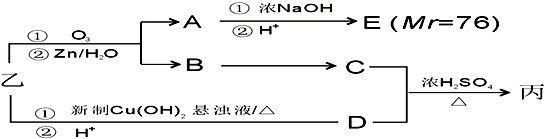
查看答案和解析>>
科目:高中化学 来源: 题型:
| 研碎后加入试剂1 |
| 静置 |
| KSCN溶液 |
| 新制氯水 |
| Vc |
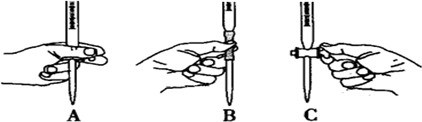
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该条件下此反应的化学平衡常数约为0.91 (L/mol)3 |
| B、A的平均反应速率为0.3mol/(L?s) |
| C、该反应在高温下可以自发进行 |
| D、若混合气体的压强不再改变时,该反应不一定达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 9 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀H2SO4能导电,所以稀H2SO4是电解质 |
| B、失去电子多的还原剂,还原性一定强 |
| C、根据是否有丁达尔效应将分散系分为溶液、胶体和浊液 |
| D、根据交叉分类法MgSO4既是镁盐又是硫酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com