
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 | |
| B. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 | |
| C. | 丙中含有第2周期ⅣA 族的元素,则丙可能是甲烷的卤代物 | |
| D. | 丁和甲中各元素质量比相同,则丁可能是C2H2 |
分析 甲是18电子的氢化物,且其水溶液为二元弱酸,不难得出甲为H2S,若乙与氧气的摩尔质量相同,可能为CH3 OH、N2H4等,丙中含有二周期IVA族的元素,可能为CH3 OH、C2H6、CH3F,丁和甲中各元素质量比相同,应为H2O2,结合各物质的结构和性质解答该题.
解答 解:A.甲是18电子的氢化物,且其水溶液为二元弱酸,不难得出甲为H2S,某钠盐溶液若为NaHS溶液,既能与盐酸等反应生成H2S,也能与NaOH反应生成Na2S,故A错误;
B.乙的摩尔质量为32 g/mol,且含有18个电子,可能为CH3 OH、N2H4等,CH3OH只含有极性键,故B错误;
C.第二周期IVA族元素为C,含有碳元素的18 电子微粒可能为CH3 OH、C2H6、CH3F,故C正确;
D.丁和甲中各元素质量比相同,H2S中元素的质量比为1:16,H2O2分子中元素的质量比也为1:16,丁为H2O2,而C2H2含有14个电子,故D错误.
故选C.
点评 本题考查无机物的推断,题目难度较大,注意熟记常见18电子、10电子物质的种类以及性质,解答本题时注意能找出反例.


科目:高中化学 来源: 题型:选择题
| A. | Zn与稀硫酸反应制取H2时,加入蒸馏水 | |
| B. | Al在O2中燃烧生成Al2O3时,用铝粉替代铝片 | |
| C. | CaCO3与稀盐酸反应生成CO2时,适当升高温度 | |
| D. | 用KClO3固体分解制取O2时,固体中添加少量MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
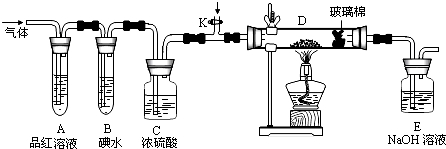
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
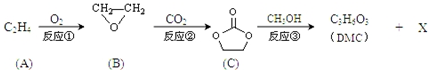
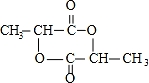 ;
;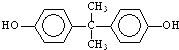 )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n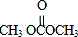 +n
+n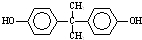 →
→ +4nCH3OH.
+4nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:
过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、水泥、石英玻璃、光导纤维均属于硅酸盐产品 | |
| B. | 煤干馏得到的煤焦油,其主要用途是经蒸馏得到燃油,这一应用可体现“低碳生活”的理念 | |
| C. | 埃博拉病毒对化学药品敏感,乙醇、酚类、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 扫描隧道显微技术、超分辨荧光显微技术等科技手段的发展,促进了人类对微观结构的探索,可实现对原子或分子的操控,使科学研究迈入更高水平 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com