Mg、A1、Fe三种金属的混合物与足量的稀H2SO4反应,生成H2 2.8L(在标准状况下),则金属混合物中三种金属的物质的量之和可能是( )
A.0.11mo1
B.0.14mo1
C.0.08mo1
D.0.15mo1
【答案】
分析:物质的量相等的金属与足量的酸反应时产生H
2的量只与金属元素的化合价有关,而已知的三种金属Mg、Al、Fe,其中Mg、Fe在反应中均呈现+2价,可把它们都看成一种成分,Al在反应中呈现+3价,把它看成另一种成分.则把该混合物转化成+2价的金属和+3价的金属组成的混合物,然后用极端法来计算和判断.
解答:解:假设全部是Mg或Fe,设它们的物质的量之和为xmol,产生的H
2有如下关系:
Mg(Fe)~~~~~~~~~~~H
2 1mol 22.4L
x 2.8L
解得x=
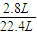
×1mol=0.125mol
假设全是Al,设它的物质的量为ymol,产生的H
2关系为:
2Al~~~~~~~~~~~~3H
2 2mol 3×22.4L
y 2.8L
解得y=
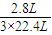
×2mol=0.08mol
由于是以上两种情况的混合物,故产生2.8lH
2时的混合物的物质的量之和应介于二者之间,即介于0.08mol~0.125mol之间.
故答案为:A.
点评:考查混合物的计算,难度中等,本题采取极端法解答,极端法是化学计算中的一种技巧性解法,对于混合物范围计算比较适用,该方法的解题思路是假设只有混合物中的某一成份,通过计算得出两个极端值.

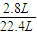 ×1mol=0.125mol
×1mol=0.125mol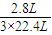 ×2mol=0.08mol
×2mol=0.08mol

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案