
【题目】下列物质中,在不同条件下可以发生氧化、消去、酯化反应的为
A. 乙醇B. 乙醛C. 苯酚D. 乙酸
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga 基态原子核外电子排布式为 ____,As 基态原子核外有_________个未成对电子。
(2)Ga、As、Se 的第一电离能中大到小的顺序是 __________,Ga、As、Se 的电负性由大到小的顺序是 ____。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_____。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3 的熔点超过 1000 ℃,可能的原因是 _____________。
(4)二水合草酸镓的结构如图 1 所示,其中镓原子的配位数为_____,草酸根中碳原子的杂化轨道类型为 ____。
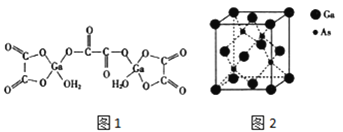
(5)砷化镓的立方晶胞结构如图 2 所示,晶胞参数为 a=0.565nm,砷化镓晶体的密度为_____g/ cm3(设 NA为阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图 1 所示装置制备 KClO 溶液,并通过 KClO 溶液与 FeCl3 溶液的反应制备高效水处理剂K2FeO4。已知 K2FeO4 具有下列性质: ①可溶于水,微溶于饱和 KOH 溶液;②在 0~5 ℃的强碱性溶液中比较稳定;③在 Fe3+和 Fe(OH)3 催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成 Fe(OH)3 和 O2。
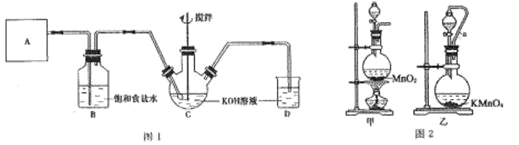
回答下列问题:
(1)装置A 用于产生氯气,若选用图 2 中的甲装置,反应的离子方程式是_____,若选用装置乙,其中的导管 a 的作用是_____。
(2)Cl2 与 KOH 在较高温度下反应生成 KClO3。在不改变 KOH 溶液的浓度和体积的条件下,控制反应在0--5℃进行。实验中可采取的措施是_____;在通入氯气的过程中,不断搅拌的目的是_____。
(3)制备 K2FeO4 时,KClO 饱和溶液与 FeCl3 饱和溶液的混合方式为_____,反应的离子方程式是_____。
(4)提纯 K2FeO4 粗产品[ 含有 Fe(OH)3、KCl 等杂质]的实验方案为:将 K2FeO4 粗产品溶于冷的3 mol/LKOH 溶液中__________(填操作名称),将滤液置于冰水浴中,再加入_________,搅拌、静置、再过滤,晶体用适量乙醇洗涤 2--3 次后,在真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.
根据图示回答下列问题:

(1)写出A、B、C、D、E的结构简式:A_____,B_____,C_____,D_____,E_____;
(2)写出②、④两步反应的化学方程式:
②_________________________________;
④__________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应就能实现如图所示转化的是( )
选项 | a | b | c | m |
|
A | N2 | NO | HNO3 | O2 | |
B | Na2CO3 | NaHCO3 | NaOH | CO2 | |
C | H2S | S | SO2 | O2 | |
D | Fe | FeCl2 | FeCl3 | Cl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变
D.向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com