
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صij������ϼ���ԭ�������Ĺ�ϵͼ��
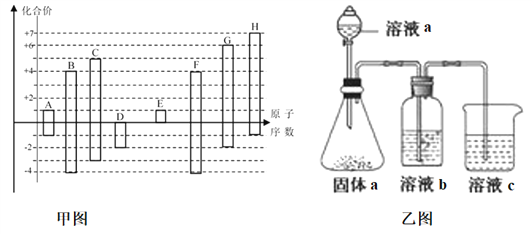
��ش��������⣺
��1��DԪ�������ڱ��е�λ��Ϊ___________��D��G�ļ��⻯���зе�ߵ���___________ ��д��ѧʽ����A��E�γɵĻ�����ĵ���ʽΪ_____________��
��2��D��E��G��H�ļ����Ӱ뾶�ɴ�С��˳��Ϊ__________________________�����û�ѧʽ��ʾ��
��3����Ԫ������X�Ǻ���CԪ�ص�18���ӷ��ӣ�1molX��l����25�� 101kPa����ȫȼ�շų�622kJ��������д����ʾXȼ���ȵ��Ȼ�ѧ����ʽ________________________________��
��4��H������������Ӧ��ˮ�����Ũ��Һ���ȶ������ȿɷֽ⣬����֮һ��H�ĵ��ʣ��ҵ���28mol����ת��ʱ�����¹�����9mol���壬д���÷�Ӧ�Ļ�ѧ����ʽ___________________________________��
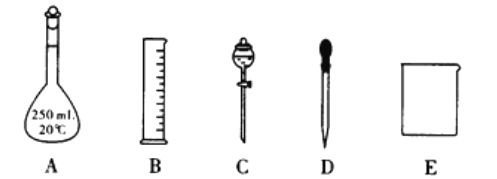
��5��������Ԫ���еļ������a��b��c�����ʣ�ijͬѧ���ʵ������ͼװ��֤��Ԫ��B��C��F�ķǽ�����ǿ����������Һb����Һc��Ϊ��������
����Һa��b�ֱ�Ϊ________��________���ѧʽ����
����Һc�е����ӷ���ʽΪ__________________________________________��
�����ԭ�ӽṹ�ĽǶȽ��ͷǽ�����C��B��ԭ�� ____________________________________________________��
���𰸡� �ڶ����ڵ���A�� H2O ![]() S2->Cl->O2->Na+ N2H4(l)+O2(g)=N2(g)+2H2O(l) ��H=-622kJmol-1 4HClO4
S2->Cl->O2->Na+ N2H4(l)+O2(g)=N2(g)+2H2O(l) ��H=-622kJmol-1 4HClO4![]() 2Cl2��+7O2��+2H2O HNO3 ����NaHCO3 SiO32-+CO2+H2O=H2SiO3��+CO32- ̼�͵���Ԫ��λ��ͬһ���ڣ����Ӳ�����ͬ������̼��ԭ��������ԭ�Ӱ뾶С��ԭ�Ӻ˶��������ӵ���������ǿ�����Ե���̼�ķǽ�����ǿ
2Cl2��+7O2��+2H2O HNO3 ����NaHCO3 SiO32-+CO2+H2O=H2SiO3��+CO32- ̼�͵���Ԫ��λ��ͬһ���ڣ����Ӳ�����ͬ������̼��ԭ��������ԭ�Ӱ뾶С��ԭ�Ӻ˶��������ӵ���������ǿ�����Ե���̼�ķǽ�����ǿ
�������������������=�����������������=����������-8��F��O�����ۣ������ԭ��������С��ϵ��֪��AΪHԪ�ء�BΪCԪ�ء�CΪNԪ�ء�DΪOԪ�ء�EΪNaԪ����FΪSiԪ�ء�GΪSԪ�ء�HΪClԪ����
��1��DΪOԪ�أ���DԪ�������ڱ��е�λ��Ϊ���ڶ����ڵڢ�A�壻D��G�ļ��⻯��ֱ�Ϊ��H2O��H2S���е�ߵ���H2O��A��E�γɵĻ�����ΪNaH�������ӻ��������ʽΪ��![]() ��
��
��2��D��E��G��H�ļ����ӷֱ�Ϊ��O2-��Na+��S2-��Cl-��S2-��Cl-��3�����Ӳ㣬O2-��Na+ֻ��2�����Ӳ㣬���ݵ��Ӳ�Խ�࣬�뾶Խ���Ӳ�ṹ��ͬ��ԭ������Խ�뾶ԽС����D��E��G��H�ļ����Ӱ뾶�ɴ�С��˳��Ϊ��S2->Cl->O2->Na+��
��3��CΪNԪ�أ���NԪ�صĶ�Ԫ������X��18���ӷ��ӣ���XΪN2H4��������֪��������ʾN2H4ȼ���ȵ��Ȼ�ѧ����ʽΪ��N2H4(l)+O2(g)=N2(g)+2H2O(l) ��H=-622kJmol-1��
��4��H������������Ӧ��ˮ����ΪHClO4������֪��HClO4���ȷֽ����֮һ��Cl2�����ݵ���ת���غ��֪����Ԫ�ر�������������������ԭ���غ㣬����ˮ���ɣ�ClԪ�ػ��ϼ���+7��Ϊ0������28mol����ת��ʱ���õ�����Ϊ��28mol�£�7��2��=2mol����������Ϊ9mol-2mol=7mol����Ӧ����ʽΪ��4HClO4![]() 2Cl2��+7O2��+2H2O��
2Cl2��+7O2��+2H2O��
��5���ٷǽ�����ǿ��������������Ӧˮ���������ǿ���йأ�B��C��FԪ�طֱ�Ϊ��C��N��Si��������������Ӧ��ˮ����ֱ�Ϊ��H2CO3��HNO3��H2SiO3��������Һ�е�ǿ��������ԭ������ҺaΪHNO3������aΪNa2CO3����ҺbΪ����NaHCO3��Һ�����ڳ�ȥCO2�е�HNO3����ҺcΪNa2SiO3��Һ������Ϊ��ҺcΪNa2SiO3��Һ����ƿ�в�����CO2����Һb���������ձ���Na2SiO3��Һ��Ӧ����H2SiO3���������ӷ���ʽΪ��SiO32-+CO2+H2O=H2SiO3��+CO32-����BΪ̼Ԫ�ء�CΪ��Ԫ�أ�̼�͵���Ԫ��λ��ͬһ���ڣ����Ӳ�����ͬ������̼��ԭ��������ԭ�Ӱ뾶С��ԭ�Ӻ˶��������ӵ��������������õ�������ǿ�����Ե�Ԫ�صķǽ�����ǿ��̼Ԫ�ء�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�и�����Ũ�ȹ�ϵ��ȷ���ǣ� ��
A.�����£�pH��7�Ĵ���ʹ����ƵĻ����Һ�У�c��CH3COO������c��Na+��
B.�������ơ���������Һ��Ϻ���Һ�����ԣ����Ϻ����Һ�У�c��Na+��=c��Cl����
C.��pH�İ�ˮ��KOH��Һ��Ba��OH��2��Һ�У�c��NH ![]() ��=c��K+��=c��Ba2+��
��=c��K+��=c��Ba2+��
D.0.2mol?L��1ijһԪ����HA��Һ��0.1mol?L��1NaOH��Һ�������Ϻ����Һ��2c��OH����+c��A����=2c��H+��+c��HA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��ʵ������֤����ˮ������������ǣ���ʵ��������в������̣���Щ�������̵���ȷ����˳���ǣ�������
��ȡ�������ۺ�ˮ�Ƴ���Һ���ڼ�����С��ۼ����Һ�к����ԡ��ܼ�������Cu(OH)2��������Һ���ݼ�������ϡ���ᡡ���ټ���
A.�٢ڢݢޢܢ�B.�٢ݢڢܢޢ�
C.�٢ݢڢۢܢ�D.�٢ޢܢݢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ֵ���ֱ�ӻ������ɵ��ǣ� ��
A.FeCl3B.NO2C.SO3D.CuS
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ѩ�ֺ�ʱ����ʹ��һ����ѩ��������Ҫ�ɷֵĻ�ѧʽΪXY2��X��Y��Ϊ���ڱ�ǰ20��Ԫ�أ��������Ӻ������ӵĵ��Ӳ�ṹ��ͬ����1 mol XY2����54 mol���ӡ�
(1)����ѩ���Ļ�ѧʽ��___���������л�ѧ��������_____������ʽ��__________��
(2)Ԫ��D��Eԭ�ӵ�����������������Ӳ�����2����D��Y���ڣ���D�����ӽṹʾ��ͼ��_________��D��E���γ�һ�ֽṹ������CO2����ԭ�ӷ��ӣ���ÿ��ԭ�Ӿ��ﵽ��8e���ȶ��ṹ���÷��ӵĵ���ʽΪ______����ѧ������Ϊ_____(����Ӽ������ۼ���)��
(3)W����Dͬ����Ķ�����Ԫ�أ�Z�ǵ������ڽ�������ǿ��Ԫ�أ�Z�ĵ�����W�ij��������з�Ӧʱ�����ֲ��������ʱ����____________���仯ѧ������Ϊ__________������ʱ����__________���仯ѧ������Ϊ________������ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������ɳ�����չ�������,��Դ�������������Լ��ճ�����ȶ��벻����ѧ��
��1���������ǽ������ϵ����ǡ���ٳ�һ�ֺ���Ԫ�صIJ�������:__________��
��2��������Ũ��ˮ�����������ܵ��Ƿ�©�����ô˷������۲쵽��������___________��
��3��ijУ������ȤС���ڴ�����ˮ��Ʒʱ���轫��������Ϊ37%��Ũ����(�ܶ�Ϊ1.19g��cm-3)���Ƴ�250mL0.1mol��L-1�����ᡣ
������ͼ��ʾ������,����������ԭ����Ҫ����________������ĸ)����ͼ������������,����������Һ����Ҫ�IJ���������_______________��
��������ʱ������������ȷ,�ձ�û��ϴ��,��������Һ�����ʵ���Ũ��_________(�ƫ�ߡ�,��ƫ�͡�����Ӱ�족,��ͬ)������ʱ����,��������Һ�����ʵ���Ũ��_______��
��4������Ʒ��������һ����������Ĥ����������,��������Ĥ�ױ��ᡢ���ƻ����������������������Ƶ���Һ����,��Ӧ�����ӷ���ʽΪ______________________��
��5����ҵ����������(��SiO2������)����������Na2SiO3��NaAlO2�����Һ���Ƶ�Al(OH��3,��Ҫ�������Լ���ѡ������,���ѡ�õ��Լ������__________������ĸ)��
a.NaOH��Һ b.��ˮ c.CO2 d.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����������������п�۷�Ӧʱ��Ϊ�˼�����Ӧ���ʣ��Ҳ�Ӱ���������������������������м��������ģ�������
A.NaNO3 ����Һ��
B.CH3COONa�����壩
C.Na2CO3����Һ��
D.CuSO4 �����壩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӫ��ǿ������Ϊ��ʳ���Ӫ����ֵ��ǿ�����ӵ����ʣ�����ʳ���мӵ⣬��Ϊ��Ԥ����ȱ�����ķ�����ʳ���мӵ⣬����������ָ����(����)
A.�ⵥ��B.�����
C.�⻯��D.�ε����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͳ�ƣ�ÿ�����ڸ�ʴ��ֱ����ĵĽ�������Լռ�����������10%�����д�ʩ�У����ܷ�ֹ������ʴ���ǣ�������
A.�ڽ�������Ϳһ������
B.�ڽ�������Ϳ����
C.�ڽ�������Ϳʳ����Һ
D.�ڽ��������һ�㲻���ý���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com