
分析 (1)要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,依据电荷守恒计算溶液中铵根离子浓度;
(2)依据配制溶液体积选项合适规格的容量瓶;
(3)依据m=CVM计算选用溶质的质量;
(4)依据溶液中所含离子成分及浓浓度关系判断解答.
解答 解:(1)且要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,依据溶液中电荷守恒规律可知:
c(Cl-)+2c(SO42-)=c(K+)+C(NH4+),0.4mol/L+2×0.4mol/L=0.4mol/L+C(NH4+),得C(NH4+)=
0.8mol/L;
故答案为:0.8mol/L;
(2)配制培养液450mL,需要选择500mL容量瓶;
故选:B;
(3)要求该培养液中c(Cl-)=c(K+)=0.4mol•L-1,C(NH4+)=0.8mol/L,则需要氯化钾的物质的量浓度为0.4mol/L,需要氯化钾固体质量m=0.4mol/L×0.5L×74.5g/mol=14.9g;
要使c(SO42-)=0.4mol•L-1,C(NH4+)=0.8mol/L,则需要硫酸铵的物质的量浓度为0.4mol/L,需要硫酸铵固体质量m=0.4mol/L×0.5L×132g/mol=26.4g;
故答案为:14.9;26.4;
(4)配制含有NH4+、Cl-、K+、SO42-的植物培养液450mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42-)=0.4mol•L-1,可以用:0.2molNH4Cl、0.1molK2SO4、0.1mol(NH4)2SO4.
故答案为:NH4Cl、K2SO4、(NH4)2SO4.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作过程是解题关键,注意溶液中遵循电荷守恒,题目难度中等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用A装置,若A为浓醋酸、B为碳酸钠(粉状)、C为苯酚钠溶液,一定能验证醋酸、碳酸、苯酚酸性的强弱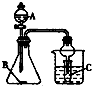 | |
| B. | 利用B装置可以完成乙酸乙酯制取实验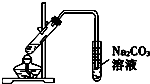 | |
| C. | 利用C装置可以完成石油蒸馏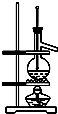 | |
| D. | 利用D装置可以完成实验室制乙烯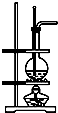 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①⑤⑥ | B. | ②④⑦ | C. | ①⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基还原为氨基:
硝基还原为氨基: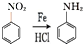
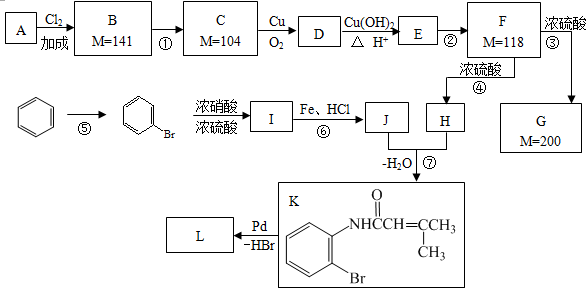
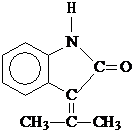 .
.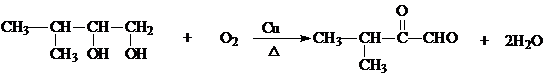 .
. .
.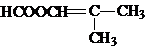 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
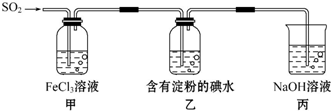
| A. | 为了验证Fe3+被SO2还原得到Fe2+,可向甲中加入KMnO4溶液,看紫红色是否褪去 | |
| B. | 甲中加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀说明SO2可以被Fe3+氧化 | |
| C. | 能表明I-的还原性弱于SO2的现象是乙中蓝色溶液褪色 | |
| D. | 装置丙的作用是吸收SO2尾气,防止污染空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②⑤ | C. | ③④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的单质氧化性:Z>Y>X | B. | 最高正化合价:Z>Y | ||
| C. | 原子半径:Z<Y<X | D. | 气态氢化物的稳定性:Z<Y<X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com