(2013?杭州一模)羟胺(NH
2OH)可看成是氨分子内的l 个氢原子被羟基取代的物质,常用作还原剂,其水溶液显弱碱性.工业上可以用如下流程制取盐酸羟胺(NH
2OH?HCl 或[NH
3OH]
+C1
-)
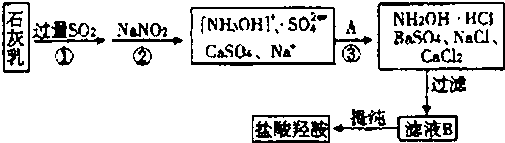
( 1 ) NH
2OH 的水溶液呈弱碱性的原理与NH
3的水溶液相似,用电离方程式表示NH
2OH 在水溶液中显碱性的原因
NH2OH+H2O?[NH3OH]++OH-
NH2OH+H2O?[NH3OH]++OH-
.
(2)某离子化合物的组成元素与羟胺相同,其水溶液显酸性.用离子方程式表示该离子化合物的水溶液显酸性的原因
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.
(3)上述流程①中发生反应的离子方程式为
Ca(OH)2+2SO2=Ca2++2HSO3-
Ca(OH)2+2SO2=Ca2++2HSO3-
,②中发生反应的离子方程式为
NO2-+2HSO3-+Ca2++H2O=[NH3OH]++CaSO4↓+SO4 2-
NO2-+2HSO3-+Ca2++H2O=[NH3OH]++CaSO4↓+SO4 2-
,试剂A 的化学式为
BaCl2
BaCl2
.
(4)用盐酸羟胺跟氢氧化钠溶液混合可制取羟胺,写出相关反应的化学方程式
NH2OH?HCl+NaOH=NH2OH+NaCl+H2O
NH2OH?HCl+NaOH=NH2OH+NaCl+H2O
.



