
【题目】(1)在标准状况下3.2g CO与CO2的混合气体,体积为2.24L。则:混合气体的平均摩尔质量是________ CO2和CO的体积之比是________ CO2和CO的质量之比是_______,混合气体中所含氧原子的物质的量是_______
(2)若10 g密度为ρ g·cm-3的Ca(NO3)2溶液中含有4 g Ca2+,则溶液中NO3-的物质的量浓度为____________
(3)在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为 ____________________
(4)在反应3BrF3+5H2O===9HF+Br2+HBrO3+O2↑中,若有2molH2O参加反应,有_____mol水作还原剂,被水还原的溴元素____________mol;
(5)把V L含MgSO4和K2SO4的混合溶液分成五等份,一份加入含a mol NaOH的溶液恰好使镁离子完全沉淀;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为_______
(6)3.04g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀,则该浓硝酸中HNO3的物质的量浓度是 ___mol·L-1,镁的质量为______g,NO2和N2O4的混合气体中,NO2的体积分数是___,得到5.08g沉淀时,加入NaOH溶液的体积是____mL。
(7)在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/3的溴元素被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________。
【答案】32g·mol-11:311:210.125mol40ρmol·L-1![]() mol·L-14/50.8mol(10b-5a)/Vmol·L-114mol·L-10.48g80%640mL1.2mol·L-1
mol·L-14/50.8mol(10b-5a)/Vmol·L-114mol·L-10.48g80%640mL1.2mol·L-1
【解析】
(1)混合气体的物质的量为2.24/22.4mol=0.1mol,根据M=m/n=3.2/0.1g·mol-1=32g·mol-1;根据题意有:n(CO)+n(CO2)=0.1,28n(CO)+44n(CO2)=3.2,解得n(CO)=0.075mol,n(CO2)=0.025mol,根据阿伏加德罗推论,气体体积之比等于物质的量之比,即CO2和CO的体积之比为0.025:0.075=1:3;CO2和CO的质量比为1×44:3×28=11:21;混合气体中所含氧原子物质的量为(0.075×1+0.025×2)mol=0.125mol;(2)n(Ca2+)=4/20mol=0.2mol,即n(NO3-)=2n(Ca2+)=0.4mol,溶液的体积为![]() L,因此c(NO3-)=40ρmol·L-1;(3)A的物质的量为V/22.4mol,溶液的质量为
L,因此c(NO3-)=40ρmol·L-1;(3)A的物质的量为V/22.4mol,溶液的质量为![]() g,溶液的体积为
g,溶液的体积为![]() L,则该物质的物质的量浓度为
L,则该物质的物质的量浓度为![]() mol·L-1;(4)根据反应方程式,5molH2O参与反应,其中有2molH2O作还原剂,即有2molH2O参加反应,有4/5molH2O作还原剂;根据得失电子数目守恒,因此有
mol·L-1;(4)根据反应方程式,5molH2O参与反应,其中有2molH2O作还原剂,即有2molH2O参加反应,有4/5molH2O作还原剂;根据得失电子数目守恒,因此有![]() ,解得n(BrF3)=0.8mol;(5)加入NaOH,发生Mg2++2OH-=Mg(OH)2↓,计算出n(Mg2+)=a/2mol,加入BaCl2溶液,发生Ba2++SO42-=BaSO4↓,计算出n(SO42-)=bmol,则原溶液中n(Mg2+)=5a/2mol,n(SO42-)=5bmol,根据溶液呈现电中性,2n(Mg2+)+n(K+)=2n(SO42-),推出n(K+)=(10b-5a)mol,则c(K+)=(10b-5a)/Vmol·L-1;(6)根据c=1000ρω%/M=1000×1.40×63%/63mol·L-1=14mol·L-1,合金失去电子物质的量等于沉淀中OH-的物质的量,生成的沉淀是Mg(OH)2和Cu(OH)2,沉淀的质量为合金的质量与OH-质量的和,因此沉淀中m(OH-)=(5.08-3.04)g=2.04g,合n(OH-)=2.04/17mol=0.12mol,因此有64n(Cu)+24n(Mg)=3.04,2n(Cu)+2n(Mg)=0.12,解得n(Cu)=0.04mol,n(Mg)=0.02mol,m(Mg)=0.02×24g=0.48g,根据得失电子数目守恒,推出n(NO2)+2n(N2O4)=0.12,n(NO2)+n(N2O4)=2240×10-3/22.4,解得n(NO2)=0.08mol,n(N2O4)=0.02mol,NO2的体积分数即NO2的物质的量分数为0.08/0.1×100%=80%,沉淀达到最大,溶质为NaNO3,n(NaOH)=n(HNO3)-n(NO2)-2n(N2O4)=(1.4-0.08-2×0.02)mol=1.28mol,则需要NaOH的体积为1.28/2L=0.64L=640mL;(7)Fe2+的还原性强于Br-,Fe2+先于Cl2反应,令FeBr3的物质的量为cmol·L-1,根据得失电子数目守恒,
,解得n(BrF3)=0.8mol;(5)加入NaOH,发生Mg2++2OH-=Mg(OH)2↓,计算出n(Mg2+)=a/2mol,加入BaCl2溶液,发生Ba2++SO42-=BaSO4↓,计算出n(SO42-)=bmol,则原溶液中n(Mg2+)=5a/2mol,n(SO42-)=5bmol,根据溶液呈现电中性,2n(Mg2+)+n(K+)=2n(SO42-),推出n(K+)=(10b-5a)mol,则c(K+)=(10b-5a)/Vmol·L-1;(6)根据c=1000ρω%/M=1000×1.40×63%/63mol·L-1=14mol·L-1,合金失去电子物质的量等于沉淀中OH-的物质的量,生成的沉淀是Mg(OH)2和Cu(OH)2,沉淀的质量为合金的质量与OH-质量的和,因此沉淀中m(OH-)=(5.08-3.04)g=2.04g,合n(OH-)=2.04/17mol=0.12mol,因此有64n(Cu)+24n(Mg)=3.04,2n(Cu)+2n(Mg)=0.12,解得n(Cu)=0.04mol,n(Mg)=0.02mol,m(Mg)=0.02×24g=0.48g,根据得失电子数目守恒,推出n(NO2)+2n(N2O4)=0.12,n(NO2)+n(N2O4)=2240×10-3/22.4,解得n(NO2)=0.08mol,n(N2O4)=0.02mol,NO2的体积分数即NO2的物质的量分数为0.08/0.1×100%=80%,沉淀达到最大,溶质为NaNO3,n(NaOH)=n(HNO3)-n(NO2)-2n(N2O4)=(1.4-0.08-2×0.02)mol=1.28mol,则需要NaOH的体积为1.28/2L=0.64L=640mL;(7)Fe2+的还原性强于Br-,Fe2+先于Cl2反应,令FeBr3的物质的量为cmol·L-1,根据得失电子数目守恒,![]() ,解得c=1.2mol·L-1。
,解得c=1.2mol·L-1。


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料和燃料,CO、CO2在催化剂的作用下都可以合成甲醇。
Ⅰ. 工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是___________(填字母)。
A. CH3OH的浓度不再发生变化 B. 生成CH3OH的速率与消耗CO的速率相等
C. 氢气的体积分数保持不变 D. 混合气体的密度不变
(2)为研究平衡时CO的转化率与反应物投料比![]() 及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
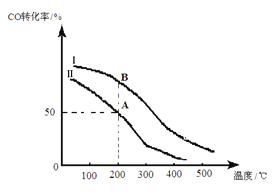
①反应热△H_______0(填“>”或“<”),判断依据是__________________________。
②若其他条件相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。
a. 投料比:Ⅰ______Ⅱ(填“>”、“<”或“=”)。
b. 若Ⅱ反应的n(CO)起始=10 mol、 投料比为0.5,A点的平衡常数KA =________,B点的平衡常数KB_______KA (填“>”、“<”或“=”)。
③要提高CO的转化率,可以采取的措施是_______________。(填字母)
a. 升温 b. 加入催化剂
c. 增大压强 d. 加入惰性气体
Ⅱ. 用CO2在催化剂的作用下合成甲醇的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。
CH3OH(g)+H2O(g)某密闭容器中充入3 mol氢气和1 mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如下图所示。
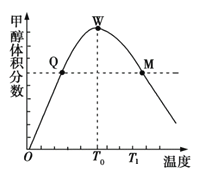
(1)下图中Q点的速率υ正_______υ逆(填“>”、“<”或“=”)。
(2)解释T0~T1内甲醇的体积分数变化趋势的原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入lmol X和2molY,发生如下反应:X(g) + 2Y(g)![]() M(g) + 2N(g) △H=akJ/mol(a>0),下列说法中正确的是:
M(g) + 2N(g) △H=akJ/mol(a>0),下列说法中正确的是:
A. v正(M)=2v逆(N)时,反应到达平衡状态
B. 到达平衡状态时,反应吸收akJ能量
C. 2s 末反应达到平衡时,加入催化剂,反应速率不会发生改变
D. 2s 末反应达到平衡时,Y的消耗量是X的生成量的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 T ℃时,将ag NH3完全溶于水,得到V mL 溶液,假设该溶液的密度为d g/mL,溶质的质量分数为w,其中含 NH4 +的物质的量为b mol。下列叙述中正确的是
A. 溶质的质量分数为 w=1000a/17V×100%
B. 溶质的物质的量浓度 c=1000a/17V mol·L-1
C. 溶液中 c(OH-)=1000b/17V mol·L-1
D. 上述溶液中再加入V mL 水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年3月11日在日本发生的大地震中,福岛核电站发生了核泄漏,其周边区域的空气中漂浮着放射性物质,其中含有碘的同位素13153I,13153I中的质子数为
A. 53 B. 78 C. 131 D. 184
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体的制备方法:________________________化学方程式为_____________________。FeCl3净水的原理__________(离子方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验中需用0.2 mol/L的Na2CO3溶液450 mL,配制时应称取Na2CO3固体的质量为_______
(2)下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:
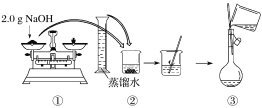

该同学的错误步骤有____________处
(3)配制220 mL 1.0 mol·L-1硫酸溶液:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用_______mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______________________
(4)在配制4.6 mol/L稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)?
①容量瓶检漏后未干燥就使用:____________。
②定容时仰视观察液面:_____。
③移液后未洗涤烧杯和玻璃棒:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式对应正确的是( )
A.铜绿﹣CuSO45H2O
B.明矾一KAl(SO4)212H2O
C.苏打一 NaHCO3
D.铁红一Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为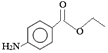 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子中含有3种官能团
B. 1 mol该化合物最多与4 mol氢气发生加成反应
C. 苯环上有2个取代基,且含有硝基的同分异构体有15种
D. 1mol该有机物水解时只能消耗2molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com