
【题目】在5L Na2SO4溶液中含有Na+离子4.6g,则溶液中SO42-离子的物质的量浓度为( )
A. 0.2mol·L-1 B. 0.04 mol·L-1 C. 0.08 mol·L-1 D. 0.02mol·L-1
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①、2H2O+Cl2+SO2=H2SO4+2HCl
②、 KMnO4+ HCl(浓)= KCl+__MnCl2+___Cl2↑+___H2O
针对上述两个反应回答:
(1)配平②的化学方程式________;
(2)用单线桥标出①中电子转移的方向和数目________;
(3)Cl2、SO2和KMnO4的氧化性强弱顺序为____;
(4)反应①中氧化产物和还原产物的物质的量之比为___;
(5)反应②中氯化氢表现出的性质是___。
A.还原性 B.酸性 C.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10L密闭容器中加入5molSO2、4molO2 , 经10min后反应达平衡时有3molSO2发生了反应.试计算:
(1)用SO2表示该反应的反应速率为多少 .
(2)平衡时O2的转化率为 .
(3)平衡时O2在反应混合气中的物质的量分数 .
(4)平衡常数K值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ
C.由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨没有金刚石稳定
D.在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第周期,第族;
(2)X可形成双原子分子,其分子的电子式是;Y和氢元素形成的10电子微粒中常见的+1价阳离子为(填化学式,下同);Z和氢元素形成的18电子微粒中常见的﹣1价阴离子为;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2 , 该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( ) 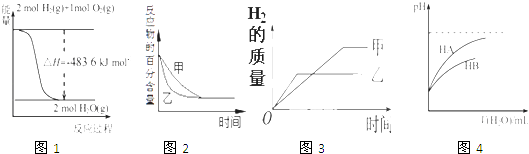
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJmol﹣1
B.图2表示压强对可逆反应2A(g)+2 B(g)3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
A. 22.4LO2中含有NA个氧分子
B. 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L
C. 标准状况下,22.4LH2O中含有的水分子数是NA个
D. 3.4gNH3含有的氨分子数为0.2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO45H2O)及副产物ZnO.制备流程图如下: 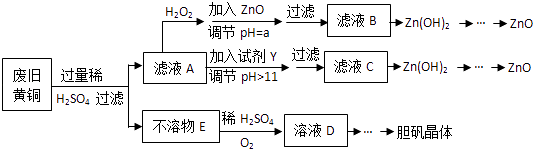
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算).
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是 , a的范围是 .
(2)由不溶物E生成溶液D的化学方程式为 .
(3)滤液A中加入H2O2反应的离子方程式为 .
(4)由溶液D制胆矾晶体包含的主要操作步骤是 .
(5)下列试剂可作为Y试剂的是 . A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂的操作方法,正确的是
A. NH3中混有少量水蒸气:通过装有浓硫酸的洗气瓶
B. NO中混有少量NO2气体:用水洗涤后再干燥
C. 食盐中混有少量NH4Cl:加过量烧碱溶液后加热蒸干
D. 硝酸混有少量硫酸:加适量BaCl2后再过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com