
 N2H4·2H2O+2H+(合理给分)(2分)
N2H4·2H2O+2H+(合理给分)(2分)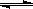 N2H4·2H2O+2H+。
N2H4·2H2O+2H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
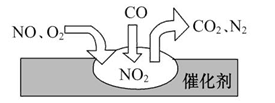
| A.反应中NO为氧化剂,N2为氧化产物 |
| B.汽车尾气的主要污染成分包括CO、NO和N2 |
| C.NO和O2必须在催化剂表面才能反应 |
D.催化转化总反应为2NO+O2+4CO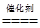 4CO2+N2 4CO2+N2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应是分解反应 |
| B.该反应是放热反应 |
| C.该反应生成物的化学式为 Fe2S3 |
| D.生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
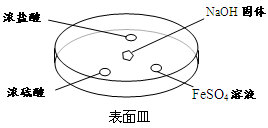
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 实验过程 | 实验现象 |
| I.检验装置的气密性 | |
| II.…… | |
| III.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | ①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.2mL | B.2.4mL | C.3.6mL | D.3mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com