
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.分析 (1)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,存在NaCl中氯元素的化合价未变化,据此解答;
②ClO2是还原产物,氯元素的化合价由+5价降低为+4价,转移电子物质的量等于ClO2的物质的量;
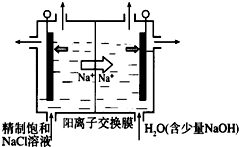
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;
②在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=$\frac{V}{Vm}$计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量,电解中H+浓度减小,使得H2O?OH-+H+的平衡向右移动;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子;根据方程式计算需要ClO2的物质的量n=$\frac{V}{Vm}$计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量.
解答 解:(1)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,HCl起还原剂注意,同时存在NaCl中氯元素的化合价未变化,故HCl还起酸的作用,故答案为:AB;
②ClO2是还原产物,氯元素的化合价由+5价降低为+4价,转移电子物质的量为0.1mol×(5-4)=0.1mol,
故答案为:0.1mol;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,电解中阴极H+浓度减小,使得H2O?OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:0.01;在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O?OH-+H+的平衡向右移动,OH-浓度增大,pH增大;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,100m3废水中CN-质量=100m3×ag/m3=100ag,CN-的物质的量为$\frac{100ag}{26g/mol}$=$\frac{50a}{13}$mol,由方程式可知,至少需要ClO2的物质的量$\frac{50a}{13}$mol,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-;$\frac{50a}{13}$mol.
点评 本题考查氧化还原反应、常用化学用语、电解原理、化学计算等,题目难度中等,电解反应是难点、易错点,是对学生综合能力的考查,需要学生具有扎实的基础与分析解决问题的能力.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏烧瓶中盛约$\frac{1}{3}$体积的自来水,并放入几粒沸石 | |
| B. | 将温度计水银球与支管口保持水平 | |
| C. | 冷水从冷凝管下口出,上口入 | |
| D. | 收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 该反应属于复分解反应 | D. | 氯气氧化性比溴单质强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥ | B. | ②④⑥ | C. | ⑤⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙CaCO3熟石灰 | B. | 氢氧化钠NaOH纯碱 | ||
| C. | 碳酸钠Na2CO3苏打 | D. | 碳酸氢钠NaHCO3苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a为电源的负极 | |
| B. | 负极反应方程式为:Ag-e-+Cl-═AgCl | |
| C. | 阴极的电极反应式为2HSO3-+2H++2e-═S2O42-+2H2O | |
| D. | 当电路中转移电子的物质的量为5×10-5 mol时,进入传感器的SO2为1.12 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com