
|
下列制取气体的实验,其气体的收集方法正确的是 | |
| [ ] | |
A. |
用排水法收集铜与浓硝酸反应产生的气体 |
B. |
用排饱和食盐水的方法收集氯化铵与熟石灰反应产生的气体 |
C. |
用排饱和碳酸氢钠溶液的方法收集石灰石与稀盐酸反应的气体 |
D. |
用向上排空气法收集铁与稀硝酸反应生成的气体 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
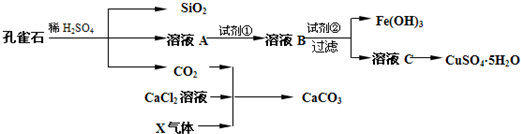 请回答下列问题:
请回答下列问题: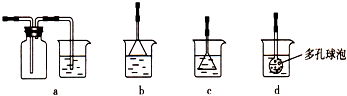
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 高温 |
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试 管中滴入几滴KSCN溶液. |
|
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2SO3+S+5H2O ![]() Na2S2O3·5H2O
Na2S2O3·5H2O
现用Na2S、Na2CO3的混合液,Na2SO3固体和稀H2SO4等试剂合成大苏打,按下列要求回答问题:
(1)制取SO2的化学方程式 。
(2)反应过程中溶液的pH逐步下降,同时析出黄色硫的有关化学反应方程式是:
① 。
② 。
③ 。
(3)合成大苏打时,Na2S与Na2CO3的最适宜的物质的量之比为 。
(4)当溶液pH下降到7左右,在加热条件下,溶液变得无色澄清时,欲得Na2S2O3·5H2O晶体,可采取的措施是 。
①趁热过滤
②蒸发浓缩后冷却结晶
(5)在下图所示的方框中画出制取气体的实验装置示意图(包括反应时容器中的物质),已知气流方向从左到右。所用仪器的简单画法如下:
敞口玻璃容器![]() 有塞玻璃容器
有塞玻璃容器![]() 普通漏斗
普通漏斗![]() 分液漏斗
分液漏斗![]()
玻璃导管![]() (应标明在液面上或液面下)
(应标明在液面上或液面下)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com