
| A. | 3.4 mol | B. | 4 mol | C. | 2.8 mol | D. | 1.2 mol |
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:解答题
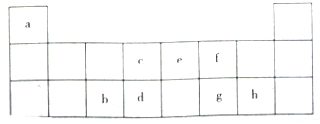 如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$ -CH3+HBr;
-CH3+HBr; .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ .
. +
+ $→_{△}^{浓硫酸}$H2O+
$→_{△}^{浓硫酸}$H2O+ .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径X>Y | B. | 原子半径X<Y | ||
| C. | 原子序数X<Y | D. | 原子最外层电子数X<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某校课外活动小组的同学在完成课本乙醇氧化制乙醛的实验后,改进了实验方案(如图),进行如下实验操作(顺序已打乱):
某校课外活动小组的同学在完成课本乙醇氧化制乙醛的实验后,改进了实验方案(如图),进行如下实验操作(顺序已打乱):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体都是均匀透明的液体 | |
| B. | 胶体粒子能透过半透膜而溶液不能 | |
| C. | 胶体与溶液的本质区别在于粒子直径的大小不同 | |
| D. | 利用丁达尔效应可区别浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2溶于水和H2SO3分解 | |
| B. | H2跟I2化合成HI和HI分解 | |
| C. | SO2跟O2化合成SO3和SO3分解 | |
| D. | 电解水生成H2与O2和H2与O2转化成H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室排放的SO2 | B. | 火山爆发产生的SO2 | ||
| C. | 燃烧煤和石油产品产生的SO2 | D. | 工业制硫酸排放的SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com