
【题目】下列离子方程式正确的是( )
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B. FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O
C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 电解MgCl2水溶液的离子方程式:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
【答案】A
【解析】试题分析: A、OH-先和Al3+反应生成沉淀,再和铵根离子反应,沉淀再溶解; NH4Al(SO4)2和Ba(OH)2物质的量之比为1:2反应,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3H2O,A正确;B、FeCl2酸性溶液放在空气中变质的离子方程式为4Fe2++4H++O2=4Fe3++2H2O,B错误;C、用CH3COOH溶解CaCO3的离子方程式为CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,C错误;D、电解MgCl2水溶液的离子方程式:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑,D错误。答案选A。
Mg(OH)2↓+H2↑+Cl2↑,D错误。答案选A。


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法正确的是

A.起始滤液常温下pH=7 B.试剂Ⅰ为Ba(NO3)2溶液
C.上图过程须经2次过滤 D.步骤③目的是除去CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2 + 3B2![]() 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2) =0.8mol(Ls)-1 B.v(A2) =0.4 mol(Ls)-1
C.v(C) =0.6 mol(Ls)-1 D.v(D) =0.1 mol(Ls)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
实验序号 | 实验内容 | 实验结果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
c | 加足量BaC12溶液,将所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是______________________。
(2)试写出实验b发生反应的离子方程式_______________________。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L—1) |
___________ | ___________ |
___________ | ___________ |
(4)判断混合物中是否存在K+,如果不存在,请说明理由,如果存在,请求出C(K+)的取值范围?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。那么用太阳能分解10mol水消耗的能量是____________kJ;
(2)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJmol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJmol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJmol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJmol-1
则由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________。
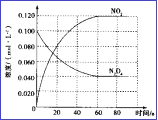
(3)在容积为1.00L的容器中,通入一定量N2O4,发生N2O4(g) ![]() 2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
(4)已知反应2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________kJ。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 若k正 = 0.0027min-1,在t=40min时,v正=_______min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。

(1)物质A的化学式为 ________。
(2)H在潮湿空气中变成M的实验现象是__________________________________________,化学方程式为___________________________________________。
(3)A和水反应生成B和C的离子方程式为___________________________________,列出A的一种重要用途_________。
(4)反应①的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:(提示:SiO2为难溶于盐酸的固体)

请回答下列问题:
(1)固体a的化学式为________。
(2)在Ⅱ中加过量的烧碱涉及到的反应离子方程式有Fe3+ + 3OH- =Fe(OH)3↓、H+ + OH- =H2O、_________________;Ⅲ中通入足量CO2气体发生反应的离子方程式为________________。
(3)由Ⅲ中得到滤液c的实验操作为_____________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)_________________________。
(4)0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合的离子反应方程式为_____________________________________。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和加入的H2SO4的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
A. 纯净的液氨中,pN=7
B. 液氨达到电离平衡时c(NH3)=c(NH4+)+c(NH2-)
C. 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3
D. 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关![]() 分子结构的下列叙述中正确的是
分子结构的下列叙述中正确的是
①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上
A. ①② B. ②③ C. ①③ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com