
 PCl3(气)+Cl2(气);△H>0 K=1 ①
PCl3(气)+Cl2(气);△H>0 K=1 ① COCl2(气);△H<0 K=5×104 ②
COCl2(气);△H<0 K=5×104 ② CO(气)+Cl2(气);△H>0③
CO(气)+Cl2(气);△H>0③ CO2(g)+H2(g);△H.得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);△H.得到以下三组数据,据此回答下列问题:| 实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650℃ | 1mol | 2mol | 0.8mol | 0.8mol | 5min |
| 2 | 900℃ | 0.5mol | 1mol | 0.2mol | 0.2mol | 3min |
| 3 | 900℃ | a mol | b mol | c mol | d mol | t |
| 0.8mol/L |
| 5min |
| 0.8 |
| 2 |
| 0.2 |
| 1 |
 CO2(g)+H2(g)
CO2(g)+H2(g)| 0.2mol/L×0.2mol/L |
| 0.3mol/L×0.8mol/L |


科目:高中化学 来源: 题型:阅读理解

| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) | ||||
| i | 150 |
|
0.1 | ||||
| ii | 150 150 |
|
5 | ||||
| iii | 350 |
|
5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 通电 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
②CO(g)+2H2(g)![]() CH3OH(g) DH2
CH3OH(g) DH2
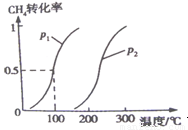
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
⑴温度不变,缩小体积,①的逆反应速率 (填“增大”、“减小”或“不变”)。
⑵反应①的DH1 0(填“<”“=”或“>”)100°C时的平衡常数值K= 。
⑶在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
300°C时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是(填字母)( )
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH2OH)减小
⑷已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)DH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-556.0 kJ·mol-1
 ③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
⑸某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。①CH4(g)+H2O (g) CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)
CH3OH(g) △H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
(1)温度不变,缩小体积,增大压强,①的反应速率 (填“增大”.“减小”.“不变”),平衡向 方向移动。
(2)反应①的△H1 0,(填“﹤”“﹦”“﹥”),其平衡常数表达式为K= ,100℃,压强为p1时平衡常数的值是 。
(3)在压强为0.1Mpa条件下,将a mol CO与3a molH2的混合气体在催化剂作用下进行反应②。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下空格中填入剩余的实验条件数据。
| 实验编号 | T℃ | n(CO)/n(H2) | p (Mpa) |
| I | 150 | 1/3 | 0.1 |
| Ⅱ |
|
| 5 |
| Ⅲ | 350 |
| 5 |
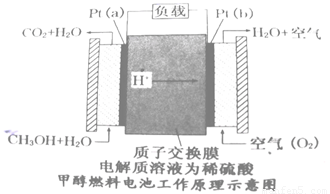
(4)近几年开发的甲醇燃料电池是采用铂电极,电池中的质子交换膜只允许质子和水分子通过,其工作原理示意图如下:
请回答
①Pt(a)电极的电极反应式为
②如果该电池工作时电路中通过2mol电子则消耗的CH3OH有 mol。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省高三第一次模拟测试试题理综化学试卷 题型:填空题
(14分)甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。①CH4(g)+H2O (g)  CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)
CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)
 CH3OH(g) △H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
CH3OH(g) △H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
(1)温度不变,缩小体积,增大压强,①的反应速率 (填“增大”.“减小”.“不变”),平衡向 方向移动。
(2)反应①的△H1 0,(填“﹤”“﹦”“﹥”),其平衡常数表达式为K= ,100℃,压强为p1时平衡常数的值是 。
(3)在压强为0.1Mpa条件下,将a mol CO与3a molH2的混合气体在催化剂作用下进行反应②。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下空格中填入剩余的实验条件数据。
|
实验编号 |
T℃ |
n(CO)/n(H2) |
p (Mpa) |
|
I |
150 |
1/3 |
0.1 |
|
Ⅱ |
|
|
5 |
|
Ⅲ |
350 |
|
5 |
(4)近几年开发的甲醇燃料电池是采用铂电极,电池中的质子交换膜只允许质子和水分子通过,其工作原理示意图如下:
请回答
①Pt(a)电极的电极反应式为
②如果该电池工作时电路中通过2mol电子则消耗的CH3OH有 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com