
����Ŀ����һ��ɫ����Һ����ȷ���Ƿ����������ӣ�K+��Mg2+��Al3+��Fe2+��Ba2+��NO3����SO42����Cl����I����HCO3�� �� ȡ����Һ��ʵ�����£�
ʵ�鲽�� | ʵ������ |
��1��ȡ��������Һ���Ӽ��μ��� | ��Һ���ɫ |
��2��ȡ��������Һ����Ũ������CuƬ��Ũ���ᣬ���� | ����ɫ����������������������Ա�ɺ���ɫ |
��3��ȡ��������Һ����BaCl2��Һ | �а�ɫ�������� |
��4��ȡ��3���е��ϲ���Һ����AgNO3��Һ | ���ȶ��İ�ɫ�������ɣ��Ҳ�����ϡ���� |
��5��ȡ��������Һ������NaOH��Һ | �а�ɫ�������ɣ���NaOH����ʱ�����������ܽ� |
�ɴ��жϣ�����˵����ȷ���ǣ� ��
A.����ʵ�飨1������ȷ����Һ�в�����HCO![]() ��I�� �� ��Ϊ������������Ӧ����Ϊ����
��I�� �� ��Ϊ������������Ӧ����Ϊ����
B.��Һ��һ�����ڵ�������NO![]() ��SO
��SO![]() ��Cl����Mg2+��Al3+����Һ�п϶������ڵ������ǣ�Fe2+��HCO
��Cl����Mg2+��Al3+����Һ�п϶������ڵ������ǣ�Fe2+��HCO![]() ��I����Ba2+
��I����Ba2+
C.Ϊ��һ��ȷ���������ӣ�Ӧ�ò�����ɫ��Ӧ��ʵ��������K+�Ϳ���
D.ͨ��ʵ�飨1���ͣ�2���Ϳ���ȷ����Һ��һ������NO![]() ��һ��������Fe2+��I����HCO
��һ��������Fe2+��I����HCO![]() ������ʵ�鲽�裨4��������Ǵ����
������ʵ�鲽�裨4��������Ǵ����
���𰸡�D
���������⣺����һ��ɫ����Һ������Fe2+ ��
�ɣ�1��ȡ��������Һ���Ӽ��μ��ȣ���Һ�Ժ�ɫ��˵����Һ��ʾ���ԣ�����HCO3�������ڣ�
�ɣ�2��ȡ��������Һ����Ũ������CuƬ��Ũ���ᣬ��������ɫ������������壨NO�����������Ա�ɺ���ɫ��������������˵����Һ�к���NO3�� �� ��һ��������I����
�ɣ�3��ȡ��������Һ����BaCl2��Һ���а�ɫ�������ɣ�����SO42����
�ɣ�4��ȡ��3���е��ϲ���ҹ����AgNO3 �� ���ȶ��İ�ɫ�������ɣ��Ҳ�����ϡ���ᣬ����Cl�� �� ���ӵ��Ȼ����к���Cl�� �� ����ԭ�����е�Cl���Ƿ���ڲ�ȷ����
�ɣ�5��ȡ��������Һ������NaOH��Һ�а�ɫ�������ɣ���NaOH����ʱ�����������ܽ⣬���������ӡ�þ���ӣ�
A������ʵ�飨1������ȷ����Һ�в�����HCO ![]() ����A����
����A����
B����Һ��һ�����ڵ�������NO ![]() ��SO
��SO ![]() Mg2+��Al3+ �� ��Һ�п϶������ڵ�������I����Ba2+��Fe2+��HCO
Mg2+��Al3+ �� ��Һ�п϶������ڵ�������I����Ba2+��Fe2+��HCO ![]() ����B����
����B����
C�������ӡ������Ӷ������жϵ����ӣ�Ϊ��һ��ȷ�����������ӣ�Ӧ�ò�����ɫ��Ӧ��ʵ�������飬���������ӵļ�����Ҫ����������C����
D��ͨ��ʵ�飨1���ͣ�2���Ϳ���ȷ����Һ��һ������NO ![]() �����䷴Ӧ�����Ӳ����ڣ���һ��������Fe2+��I����HCO
�����䷴Ӧ�����Ӳ����ڣ���һ��������Fe2+��I����HCO ![]() ���ڣ�3�������Ȼ����к��������ӣ��ڣ�4���ټ�����������������Ч�ģ���D��ȷ��
���ڣ�3�������Ȼ����к��������ӣ��ڣ�4���ټ�����������������Ч�ģ���D��ȷ��
��ѡD��


 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����C=C�����ʣ�ϩ����һ������������ˮ�����ӳɷ�Ӧ�����ɴ������ǻ���������������л���A��D�����ͼʾ��ת����ϵ�� 
����˵������ȷ���ǣ� ��
A.D�ṹ��ʽΪCH3COOCH2CH3
B.A��ʹ���Ը��������Һ��ɫ
C.B�����ᷢ����ȡ����Ӧ
D.����B��ȡ��ˮ�еĵⵥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ���ʵ���Ũ�ȵ�NaCl��MgCl2��AlCl3������Һ���������3��2��1��������Һ�������ӵ����ʵ���Ũ��֮��Ϊ
A. 3 ��4 ��3B. 1 ��2 ��3C. 1 ��1 ��1D. 6 ��3 ��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�֡��˹��̵������·������ڳ��¡���ѹ�����������£�N2�ڴ���������ˮ������Ӧ����NH3��N2+3H2O2NH3+ ![]() O2��һ���о�NH3���������¶ȵĹ�ϵ������ʵ�����ݼ�������Ӧʱ��3h����
O2��һ���о�NH3���������¶ȵĹ�ϵ������ʵ�����ݼ�������Ӧʱ��3h����
T/�� | 30 | 40 | 50 |
����NH3��/��10��6 mol�� | 4.8 | 5.9 | 6.0 |
��ش��������⣺
��1��50��ʱ�ӿ�ʼ��3h����O2���ʵ����仯��ʾ��ƽ����Ӧ����Ϊmolh��1 ��
��2���÷�Ӧ������������ϵ������ͼ��ʾ����Ӧ���Ȼ�ѧ����ʽ�ǣ� �� 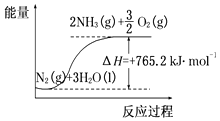
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͻ��������ص㣬��NaK�Ͻ�ΪҺ�壬��Na��K�ĵ��ʾ�Ϊ���塣�ݴˣ����Ʋ⣺������������̼���������У��۵���͵���(����)
A.����
B.����
C.̼
D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ��Ȼ�����һ�����;�ˮ��������������Ũ�ȣ���AlT��ʾ���������ࣺ��ҪΪAl3+�ĵ�����̬����Ũ�ȣ���Ala��ʾ������ҪΪ[AlO4Al12��OH��24��H2O��12]7+���еȾۺ���̬����Ũ�ȣ���Alb��ʾ����Al��OH��3������̬����Ũ�ȣ���A1c��ʾ����
��1��һ�������£���1.0mol/LAlCl3��Һ�м���0.6mol/L��NaOH��Һ�����Ƶ�Alb����ԼΪ86%�ľۺ��Ȼ�����Һ��д������[AlO4Al12��OH��24��H2O��12]7+�����ӷ���ʽ�� ��
��2����Ĥ�����MD��Ũ���������ۺ��Ȼ�����Һ����Ũ����ʵ������в�ͬŨ�Ⱦۺ��Ȼ���������̬�ֲ����ٷ����������
AlT/��molL��1�� | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
����һ���¶��£�AlTԽ��pH���Խ����ԽС�����䡱����
���罫AlT=2.520molL��1�ľۺ��Ȼ�����Һ��ˮϡ�ͣ���ϡ��������Ҫ������Ӧ�����ӷ���ʽ�� ��
��Ĥ������Һ�¶ȶ����ۺ���̬�ٷ�����������Ũ�ȵ�Ӱ����ͼ1����T��80��ʱ��AlT�����½���ԭ���� �� 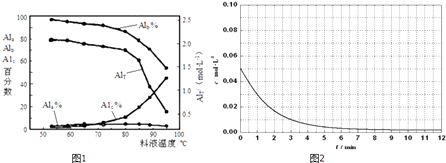
��3�����̼�Ȼ�ԭһ��������ʵ�����������Ʊ�����������ط�Ӧ���Ȼ�ѧ����ʽ���£���Al2O3��s��+AlCl3��g��+3C��s��=3AlCl��g��+3CO��g����H1=a kJmol��1
��3AlCl��g��=2Al��l��+AlCl3��g����H2=b kJmol��1
��ӦAl2O3��s��+3C��s��=2Al��l��+3CO��g����H=kJmol��1���ú�a��b�Ĵ���ʽ��ʾ������Ӧ�ٳ�ѹ����1900��ĸ����²��ܽ��У�˵����H0���������=����������
��4�������е���Ԫ�ؿ���ͨ������Ԫ��ת����Al3+ �� Ȼ����ˮ��Һ�������Լ���NH4��3C19H11O3��COO��3����Ʒ��Ϊ���������ã��ⶨ������������Һ�У�Al3+���������Լ���Ӧ������õ���ɫ�����ʣ����Ÿ÷�Ӧ�Ľ��У���Һ����ɫ���ϱ仯��������Һ��ɫ�뷴Ӧ��������Ũ�ȵĹ�ϵ������ɫ������������ȷ���û�ѧ��Ӧ�����ʣ����ڱ�ɫ������������ ��
A.pH��
B.Ԫ�ط�����
C.�ֹ��ȼ�
D.ԭ�����չ�����
��5����֪Al3++4X2[�� ![]() X2��1.5+]��X��ʾ��ɫ����
X2��1.5+]��X��ʾ��ɫ���� ![]() X21.5+��ʾ��ɫ���ʣ�ͨ����ɫ�����õ�25��ʱAl3+Ũ����ʱ��ı仯��ϵ��ͼ2��ʾ������ͬһͼ�л��
X21.5+��ʾ��ɫ���ʣ�ͨ����ɫ�����õ�25��ʱAl3+Ũ����ʱ��ı仯��ϵ��ͼ2��ʾ������ͬһͼ�л�� ![]() X21.5+Ũ����ʱ��ı仯���� ��
X21.5+Ũ����ʱ��ı仯���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������ؾ����������ṹ�����������Ļ��ϼ۲���Ϊ0�ۣ�����Ϊ��2�ۣ�����ͼ��ʾΪ�������ؾ����һ��������������˵����ȷ���ǣ� �� 
A.�������صĻ�ѧʽΪKO2 �� ÿ����������4��K+��4��O2��
B.������ÿ��K+��Χ��8��O2�� �� ÿ��O2����Χ��8��K+
C.��������ÿ��K+���������K+��8��
D.��������ÿ��K+���������K+��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ��(�г�װ����)��ȡ���ռ�����������İ�������̽�����������ʡ�
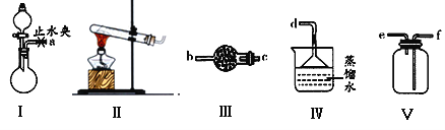
��1��ʵ������NH4Cl��Ca(OH)2��ȡ������д����Ӧ�Ļ�ѧ����ʽ��_______________��Ӧѡ�õķ���װ����_____���ܷ�������林����Ȼ��___(��ܡ����ܡ�)��
��2��������װ��I��ȡ����������ʵ��Ҫ��
���������ӵ�˳������ĸ��ű�ʾ����
a��_____�� �� �� �� ��
��װ��IӦѡ�õ��Լ�ΪŨ��ˮ_______ �� ______(����ţ���
A.���Ȼ��� B.Ũ���� C.����� D.��ʯ��
��Ϊ�˵õ�����İ�����ʵ���Ҳ������ڸ���NH3���Լ���_________��
A.Ũ���� B.��ʯ�� C.NaOH����
��3���ռ�һƿ����������ͼ����װ�ý���ʵ�顣�ȴ������٣�Bƿ�в�����ɫ������__________���ѧʽ�����ȶ��ر������٣��ٴ������ڣ�Bƿ�е�������__________________________________��
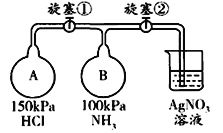
��4��������ͨ��ʢ������ͭ��ĩ�IJ������У������к�ɫ���嵥�ʺ���ɫ���嵥�����ɣ�֤����������________�ԣ���Ӧ�Ļ�ѧ����ʽ��__________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com