
(9分)在烧杯里加入20 mL 0.1 mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液。实验装置如下图(夹持仪器已去掉):
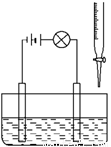
实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是 。
(2)有白色沉淀生成,说明 ,
红色变浅说明 。
(3)当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的体积为______ mL,离子反应方程式为 。
(4)若向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为 。
(1)溶液中可自由移动离子的浓度变小(1分) (2)Ba2+和SO发生了反应;
H+和OH-发生了反应,使溶液碱性减弱(每空1分)
(3)20(2分)Ba2++OH-+SO+H+===BaSO4↓+H2O(2分)(4)H++OH-===H2O(2分)
【解析】(1)氢氧化钡溶液能和碳酸氢钠反应生成白色沉淀硫酸钡和水,溶液中可自由移动离子的浓度变小,导电性减弱。
(2)有白色沉淀生成,说明Ba2+和SO发生了反应生成了硫酸钡;红色变浅说明H+和OH-发生了反应,使溶液碱性减弱。
(2)氢氧化钡是0.002mol,所以当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的物质的量是0.002mol,其体积是20ml,反应的方程式是Ba2++OH-+SO+H+===BaSO4↓+H2O。
(4)当Ba2+恰好完全沉淀时,溶液中还生成氢氧化钠,所以恰好变为无色时,反应的方程式是H++OH-===H2O。


科目:高中化学 来源: 题型:
相关物质性质如下表所示:
| 物质 | 熔点/℃ | 沸点/℃ | 相对密度(20℃) | 毒性 | 水溶性 |
| 苯 | 5.5 | 80.1 | 0.8794 | 有 | 不溶于水 |
| 硝酸 | -41.59 | 83 | 1.503 |
| 易溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 有 | 不溶于水 |
可供选择的实验用品:
①仪器:烧杯、大试管、铁架台(带铁圈)、石棉网、酒精灯、橡皮塞、玻璃管、温度计、分液漏斗等。
②药品:浓硝酸、稀硝酸、浓硫酸、稀硫酸、苯、5%NaOH溶液、蒸馏水等。
请参考以下实验设计思路,讨论并回答有关问题。
(2)选择合适的实验仪器及条件
①采用的加热方式:
________________________________________________________________________,
其优点是
________________________________________________________________________。
②反应物均为________,采用________作反应器。
③反应过程中由于有易挥发的物质,为防止损失采用________,其兼起________作用。
④用________来控制________的温度。
⑤请画出实验装置简图。
(2)安排合理的实验步骤
①按装置图组装好实验仪器。
②在大试管里,先加入1.5 mL浓硝酸和2mL浓硫酸,摇匀,冷却到50~60℃。
③再慢慢滴入1 mL苯,不断轻轻摇动,使之混合均匀,塞好单孔塞。
④放在50~60℃的水浴中加热10 min。
(3)产品提纯
探究讨论:①浓硝酸和浓硫酸的混合顺序能否颠倒?为什么?
________________________________________________________________________。
②浓硫酸的作用是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013届山东省泰安市宁阳二中高三第一次月考化学试卷(带解析) 题型:实验题
(9分)在烧杯里加入20 mL 0.1 mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液。实验装置如下图(夹持仪器已去掉):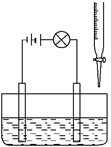
实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是 。
(2)有白色沉淀生成,说明 ,
红色变浅说明 。
(3)当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的体积为______ mL,离子反应方程式为 。
(4)若向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高考化学一轮复习《认识有机物的结构与分类、常见的烃》专题综合测试 题型:实验题
相关物质性质如下表所示:
|
物质 |
熔点/℃ |
沸点/℃ |
相对密度(20℃) |
毒性 |
水溶性 |
|
苯 |
5.5 |
80.1 |
0.8794 |
有 |
不溶于水 |
|
硝酸 |
-41.59 |
83 |
1.503 |
|
易溶于水 |
|
硝基苯 |
5.7 |
210.9 |
1.205 |
有 |
不溶于水 |
可供选择的实验用品:
①仪器:烧杯、大试管、铁架台(带铁圈)、石棉网、酒精灯、橡皮塞、玻璃管、温度计、分液漏斗等。
②药品:浓硝酸、稀硝酸、浓硫酸、稀硫酸、苯、5%NaOH溶液、蒸馏水等。
请参考以下实验设计思路,讨论并回答有关问题。
(2)选择合适的实验仪器及条件
①采用的加热方式:
________________________________________________________________________,
其优点是
________________________________________________________________________。
②反应物均为________,采用________作反应器。
③反应过程中由于有易挥发的物质,为防止损失采用________,其兼起________作用。
④用________来控制________的温度。
⑤请画出实验装置简图。
(2)安排合理的实验步骤
①按装置图组装好实验仪器。
②在大试管里,先加入1.5 mL浓硝酸和2 mL浓硫酸,摇匀,冷却到50~60℃。
③再慢慢滴入1 mL苯,不断轻轻摇动,使之混合均匀,塞好单孔塞。
④放在50~60℃的水浴中加热10 min。
(3)产品提纯
探究讨论:①浓硝酸和浓硫酸的混合顺序能否颠倒?为什么?
________________________________________________________________________。
②浓硫酸的作用是
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com