
能正确表示下列化学反应的离子方程式是 ( )
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
D.向碳酸氢钠溶液中滴加少量稀硝酸:CO32 - + 2H + = CO2 + H2O
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数,下列叙述错误的是
A.标准状况下,11. 2 L氦气中含有0.5 NA原子
B.常温常压下,46g NO2和N2O4混合气体中含有原子总数为3NA
C.标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0. 2 NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数NA个
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:填空题
(13分)【化学一有机化学基础】
I.莽草酸是有效应对H5N1型禽流感病毒的药物“达菲”的重要成分。

(1)莽草酸中可发生加成反应的官能团为______ (填名称)。
(2)等物质的量的莽草酸、甲、乙分别与NaOH溶液完全反应,消耗NaOH的物质的量之比为______。
(3)写出符合以下条件的莽草酸的同分异构体的结构简式____________。
(i)链状结构,含三种氢,有两个甲基。
(ii)能与NaOH溶液反应。
II.PET为聚合物,用于生产矿泉水塑料瓶。PET生产流程如下图:

已知:A、B、C、D、E都是苯的对位二元取代物,A为烃,E与邻苯二甲酸互为同分异构体。
(4)B→C的反应类型为______。
(5)能鉴别C和D的试剂是______。
(6)E与乙二醇反应生成PET的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
同温同压下,相同体积的CO和CO2,下列比较中正确的是( )
①所含的分子数目之比为1︰1 ②所含的O原子数目之比为1︰2
③所含的原子总数目之比为2︰3 ④两者的密度之比为:7:11
⑤所含的电子数目之比为7︰11
A.①和④ B.②和③ C.④和⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
下列各组试剂中,只用试管和胶头滴管,不用其他试剂就可以鉴别的是( )
A.NaHSO4溶液和Na2CO3溶液 B.稀盐酸和AgNO3溶液
C.AlCl3溶液和NH3·H2O溶液 D.Ba(OH)2溶液和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:实验题
(14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
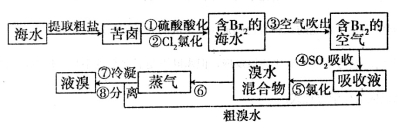
(1)步骤①中用硫酸酸化的目的是____________________________________________。
步骤②发生反应的离子方程式为_____________________________________________。
(2)步骤④利用了SO2的还原性,反应的离子方程式为___________________________。
(3)操作⑥的名称是________________。
(4)从含溴海水中吹出的溴也可用纯碱吸收。纯碱吸收溴的主要反应是:Na2CO3+Br2→NaBrO3+NaBr+CO2,吸收1molBr2时,转移的电子数为________mol。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。
(5)化学上将SCN 、OCN
、OCN 、CN
、CN 等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失。血红色消失过程中发生反应的离子方程式为______________________________________。
等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失。血红色消失过程中发生反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论不正确的是
| 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,再逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
C | 常温下,向浓硫酸中投入铝片 | 铝片不溶解 | 常温下,铝不与浓硫酸反应 |
D | 向某无色溶液中先滴加氯水,再加少量CCl4,振荡,静置 | 溶液分层,下层为橙红色 | 溶液中含有Br- |
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
己知A(s) + 2B(g)  C(g) + D(g)反应的平衡常数和温度的关系如下:
C(g) + D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
下列问题不正确的是
A.该反应的平衡常数表达式K= C(C)·C(D) / C2(B)
B.该反应的△H < 0
C.830℃时,向一个5L的密闭容器中充入10 mol A和2mol B,10min后,B为0.5mol时,此时V(正)>V(逆);
D.在温度、容积不变时,气体的密度不随时间改变能判断该反应是否达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com