
【题目】在2L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g)。若最初加入的A和B都是8 mol,在前10秒钟A的平均反应速率为0.12 mol/(Ls),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是8 mol,在前10秒钟A的平均反应速率为0.12 mol/(Ls),则10秒钟时,容器中B的物质的量是
A.5.6 molB.6.8 molC.2.4 molD.3.2 mol
【答案】B
【解析】
10秒钟A的平均反应速率为0.12 mol/(Ls),那么浓度的变化量为0.12 mol/(Ls)×10s=1.2mol/L,浓度的变化量之比等于化学计量数之比,由此可计算得到物质B的浓度的变化量,可进一步得到10秒钟时B的物质的量。
10秒钟A的平均反应速率为0.12 mol/(Ls),那么浓度的变化量为0.12 mol/(Ls)×10s=1.2mol/L,浓度的变化量之比等于化学计量数之比,由此可计算得到物质B的浓度的变化量为0.6mol/L,物质的量的变化量为0.6mol/L×2L=1.2mol,那么10秒钟时B的物质的量为8mol-1.2mol=6.8 mol;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于电化学的实验事实正确的是( )
出现环境 | 实验事实 | |
A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
B | 电解CuCl2溶液 | 电子经过负极→阴极 |
C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
D | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如下所示:

回答下列问题:
(1)A的化学名称是 ;
(2)由A生成B 的反应类型是 。在该反应的副产物中,与B互为同分异构体的化合物的结构简式为 ;
(3)写出C所有可能的结构简式 ;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用化学方程式表示合成路线 ;
(5)OPA的化学名称是 ,OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为 ,该反应的化学方程式为 。(提示![]() )
)
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某吸水材料和聚酯纤维合成路线如图所示:
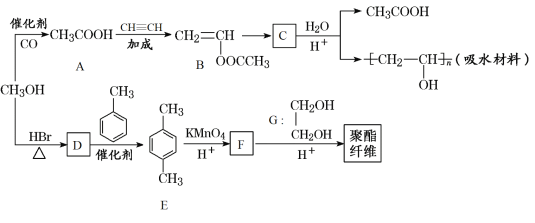
回答下列问题:
(1)B中的官能团名称是_________。
(2)B→C的反应类型是____________。
(3)请写出由CH3OH生成D的化学方程式__________。
(4)E的同分异构体H满足下列条件:①属于芳香族化合物②核磁共振氢谱有四组峰,且峰面积之比为1:1:2:6,则H的结构简式为___________。
(5)写出聚酯纤维的结构简式:_________。
(6)参照上述流程,以苯和乙烯为起始原料,选用必要无机试剂合成对硝基乙苯(![]() ),写出合成路线_______ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。提示:硝基苯一般在间位发生取代,乙苯一般在邻位或对位发生取代。
),写出合成路线_______ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。提示:硝基苯一般在间位发生取代,乙苯一般在邻位或对位发生取代。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)(氟只有两种价态:-1,0)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O![]() 2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
A. NF3是氧化剂,H2O是还原剂
B. 若1mol NF3被氧化,反应转移电子数为2NA
C. 若生成0.4molHNO3,则转移0.4mol电子
D. 氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上把Cl2通入冷NaOH溶液中制得漂白液(有效成分为NaClO)。某化学小组在一定温度下将氯气缓缓通入NaOH溶液中,模拟实验得到ClO-、ClO3-等离子的物质的量n(mol)与反应时间t(min)的关系曲线。下列说法错误的是
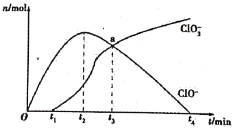
A.参加反应所需NaOH与氯气的物质的量之比一定为2:1
B.a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1
C.t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-=2Cl-+ClO3-
D.使用漂白液时,为了增强漂白效果,可以向漂白液中通入二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
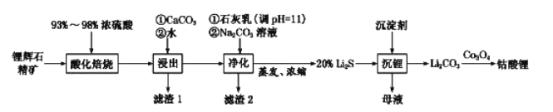
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。

回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。
②为提高“酸化焙烧”效率,常采取的措施是________。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______。(已知:完全沉淀后离子浓度低于1×l0-5)mol/L)
④“沉锂”过程所获得的“母液”中仍含有大量的Li+,可将其加入到“___________”步骤中。
⑤Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6 ![]() LixC6+Li1-xCoO2 ,其工作原理如图2。
LixC6+Li1-xCoO2 ,其工作原理如图2。

下列关于该电池的说法正确的是___________(填字母)。
A.电池反应式中过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2 极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
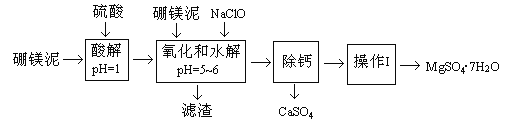
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为2Ni(OH)2![]() H2+2NiO(OH)。
H2+2NiO(OH)。

(1)为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为______________________________,总反应的化学方程式为________________________________________;
(2)不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为________(填“a”或“b”),电解槽内总反应的离子方程式为_____________________________________________;
(3)当给氢镍碱性电池充电时,该电池的阳极反应式为__________________,氢镍电池放电时,负极附近的pH会________(填“变大”、“不变”或“变小”);
(4)若将图中的稀硫酸换成CuSO4溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入0.2 mol碱式碳酸铜[Cu2(OH)2CO3]后,恰好恢复到原来的浓度和pH(不考虑CO2的溶解),则电解过程中转移电子的物质的量为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com